فصل چهارم - تیتراسیون ریاجنت ها
فصل 4
تیتراسیون ریاجنت ها
این فصل با جزیات بیشتری به مهارتهای عملی در طراحی و پایداری الایزا می پردازد.روش شناسی پایه ای برای طراحی تمام سیستم ها بحث میشود طوری که خواننده بتواند هم امکان سنجی آزمایشات را با استفاده از ریاجنتهای خود بررسی کند وهم با اعتماد کامل ریاجنتهای بدست آمده از منابع دیگررا بکار گیرد.مانند دیگر ازمایشات مهم است که محققین اصول روش را بفهمند تا بر پایه ویژگی های قابل اندازه گیری و قابل کنترل قضاوت خوبی داشته باشند.به عبارت دیگر باید فهم کامل از آنچه در ازمایشگاه انجام میشود، داشته باشند.مقصود اموزش علاوه بر ترویج ارزیابی های بحرانی ایجاد مهارت ها و درک جدید نیز است. چنین درکی لازم بوده وبا بکارگیری شاخص های آماری در نتایج و پیگیری مداوم عملکرد حاصل میشود.
1.
تیتراسیون صفحه شطرنجی
در سیستم های الایزا که قبلا توصیف شد لازم است که ریاجنتها مناسب سازی شوند.به عبارت دیگر غلظت کاری هر جزئ آزمایش باید ارزیابی شود.جدول 1 بازنگری ساده از سیستم ها و شمار ریاجنتهایی که نیاز به مناسب سازی دارد را به عنوان یاداوری نشان میدهد.
ویژگی کلیدی در این فرایند استفاده از تیتراسیون صفحه شطرنجی (CBT) است.استفاده از پلیتهای میکروتیتر یک ویژگی مهم در الایزا است.این فصل این نوع قالب را شرح میدهد.CBT در هر قالبی طوریکه در آن ریاجنتها رقیق شوند قابل انجام است اما پلیت میکروتیتر به همراه تجهیزات همراه آن در ساده سازی پی پت کردن عالی است. در ادامه روشن خواهد شد که CBT تنها روش مناسب سازی ریاجنتها نیست و اینکه اغلب ،غلظتها باید با توجه به شرایط واقعی ازمایش تعدیل شوند.
فرایند CBT شامل رقت های دو ریاجنت ضد یکدیگر است تا فعالیت ذاتی در تمام ترکیب های حاصل بررسی شود. تعداد ریاجنت هایی را که در یک پلیت می توان تیتر کرد دو تا است و این در الایزای مستقیم نشان داده شده است(زیر عنوان 1.1 را ببینید). استفاده از CBT در بعضی سیستم های دیگر با بیش از دو ریاجنت نیز مثال زده شده است.توصیف تکنیکهای پی پت کردن و رقیق کردن به طور کلی ، اساس انجام الایزا است .همانطور که خواننده با روش ها آشنا میشود جزیات کمتری برای توصیف آزمایشهای دیگر خواهد بود.
1.1
CBT برای الایزای مستقیم
شکل 1 بصورت طرحی نمای رقت سازی را نشان میدهد.قسمت بالایی شکل 1 شماره گذاری و حروف گذاری پلیت میکروتیتر را نشان میدهد.بنابراین ستون ها از 1 تا 12 نشانه گذاری شده اند و ردیف ها از A تا H .این واژه ها از این به بعد برای مشخص کردن مکان ها روی پلیت بکار برده میشوند.
1.1.1
مرحله (i) از CBT الایزای مستقیم
مرحله (i) شامل رقیق کردن آنتی ژن در یک بافر کوتینگ است.حجم هایی که در الایزا استفاده میشود معمولا 50 و 100 میکرولیتر است.دراین فصل ما 50 میکرولیتر را به عنوان حجم استاندارد اضافه شونده به چاهک ها بکار میبریم.در این مرحله معمولا یک رقت دوبرابری معمول است برای مثال یک حجم از یک چاهک برداشته میشود و به همان حجم در چاهک بعدی اضافه میشود و به همین ترتیب الی آخر.عملی ترین شیوه انجام ازمایش در ادامه میاید.
- با استفاده ازیک پی پت چند کاناله رقیق کننده را (دراین مرحله بافر کوتینگ است) به حجم 50 میکرولیتر به تمام چاهک های پلیت اضافه کنید.
- 50 میکرولیتر از یک رقت از آنتی ژن را به تمام چاهک ها در ستون 1 اضافه کنید.
- رقت اولیه را می توانید در یک ظرف کوچک تهیه کنید تا حجم لازم برای اضافه کردن به ستون 1 تهیه شود، یعنی نیاز شما برابر است با هشت چاهک ضربدر 50 میکرولیتر که برابر است با 400 میکرولیتر از آنتی ژن رقیق شده. توصیه می شود که آنتی ژن رقیق شده اولیه کمی بیشتر از آنچه که لازم است از نظر تئوری تهیه کنید چون قسمتی از مواد به ظروف می چسبد و غیره ، در این مورد 500 میکرولیتر (0.5 میلی لیتر) باید تهیه شود .
- ارزیابی رقت اولیه مبتنی بر هر دانشی از غلظت احتمالی آنتی ژن است (به عنوان مثال آنطور که در دیگر آزمایش ها ارزیابی شده است). با CBT، ارزیابی مستقیم از فعالیت طیفی از غلظتها در الایزا خواهیم داشت و بنابراین اگر یک تخمین پایین یا بالاتری از آنتی ژن بدست آید یک CBT دیگر انجام می شود تا این مشکلات بررسی گردد.خلوص احتمالی انتی ژن (غلظت آنتی ژن های اختصاصی درمقایسه با ناخالصی ها)و موجود بودن آنتی ژن باید در نظر گرفته شود.یک رقت شروع برای تمام انتی ژن ها از 10/1 تا 20/1 در بافر کوتینک میتواند باشد.اجازه دهید فرض بگیریم که 20/1 اضافه میکنیم.
- 50 میکرولیتر از آنتی ژن از پیش رقیق شده را به تمام چاهک ها در ستون A اضافه کنید.با یک پی پت چندکاناله که هشت نوک در سر آن قرار گرفته مخلوط کنید.مخلوط کردن به این معنی است که مایع در داخل چاهک در درون نوک به تعداد پنج مرتبه بالا و پایین ،پی پت میشود.این کار نباید خیلی به شدت انجام شود.
- بعد از مخلوط کردن نهایی 50 میکرولیتر از آنتی ژن رقیق شده از هشت چاهک در ستون َA بردارید و به ستون B منتقل کنید.مانند دفعه قبل مخلوط کنید.روش را تکرار کنید تا به ستون 11 . توجه کنید که هیچ انتی ژنی در ستون 12 نیست و این به عنوان یک کنترل عمل میکند(ایجاد رنگ با رقت های کنژوگه در چاهکهایی که هیچ انتی ژنی ندارد).
- بعد از عمل مخلوط کردن نهایی درستون 11 50 میکرولیتر بردارید و دور بریزید.در چاهک ها ما یک رقت دو برابری از انتی ژن در بافر کوتینگ ایجاد کردیم که از 20/1 در ستون A شروع میشود و در 20480/1 در ستون 11 ختم میشود.
- پلیت را اینکوبه کنید تا انتی ژنها طی این زمان به چاهک ها بچسبد.ماهیت و زمان اینکوباسیون باید همانطوری باشد که در روش انجام ازمایش استفاده میشود. با اینکوباسیون در شرایط ساکن به مدت 2 ساعت در 37 درجه بیشتر آنتی ژنها خواهند چسبید.با اینحال بهتر است درتمام طول شب اجازه دهید اینکوباسیون در 4 درجه صورت گیرد.هر شرایطی که انتخاب شود، باید در ادامه طراحی آزمایش دنبال شود چون تغییر در زمان ،دما یا شیوه تکان دادن یا ضربه زدن پلیتها کینتیک جذب را تغییر میدهد.
- اکنون پلیت را با پر و خالی کردن چاهکها با بافر فسفات نمکی (PBS) آنطور که در فصل 3 توصیف شده بشویید.
1.1.2
مرحله (ii) از CBT الایزای مستقیم
مرحله (ii) شامل ساخت یک سری رقت مشابه از انتی بادی کنژوگه شده ،علیه انتی ژن است .در این مورد سری رقت از ردیف A تا G ایجاد میشود.بافر اضافه شده یک بافر مسدود کننده است (که دارای غلظت نسبتا بالایی از پروتیین خنثی است تا از اتصال غیر اختصاصی پروتیین ها (فصل 3 را ببینید) جلوگیری کند).دراین مورد بافر مسدود کننده ممکن است PBS (0.1 M , PH 7.6) حاوی پودر شیر خشک (5%) و 0.05% Tween 20باشد.
طیف رقت را میتوان با استفاده از پی پت چندکاناله با 12 نوک انجام داد.باید مخلوط کردن پس ازهر اضافه کردن انجام شود.توجه کنید که هیچ رقتی از کنژوگه در ردیف H نیست این ردیف به عنوان یک کنترل برای سوبسترا و انتی ژن عمل میکند(چون این چاهکها حاوی یک طیف رقتی از انتی ژن هستند).رقت اولیه باید در ناحیه 50/1 برای کنژوگه مستقیم باشد.
- پلیت را در وضعیت چرخش (بهترین )در 37 درجه به مدت 1 ساعت یا به حالت ساکن در 37 درجه به مدت 2 ساعت قرار دهید.چاهک ها را بشویید.
- رنگزا / سوبسترا را اضافه کنید. میتواند هر یک از انواعی که درفصل 3 توصیف شد باشد و در رابطه با صحت PH بافرهای آنها توجه داشته باشید.در این مورد ما H2O2 / ارتو-فنیل ان دی امین (OPD) را به حجم 50 میکرولیتر در هر چاهک اضافه میکنیم(در هر چاهک از پلیت).
- پلیت را در حالت ساکن به مدت 15 دقیقه قرار دهید تا رنگ ایجاد شود.زمان دقیق تشکیل رنگ و شرایط باید در سنجش های بعدی ثبت شود.در این مرحله کار خوبی است که پلیت را از نظر سرعت تشکیل رنگ زیر نظر داشته باشید.
- متوقف کردن(به سیستم بستگی دارد)
- OD رنگ را در یک اسپکتروفتومتر بخوانید.
1.2
نتایج
جدول 2 نتایج را به شکل طرح ارایه میدهد. تلاش میکنیم تا رقتهای مناسب انتی ژن که در چاهک ها کوت میشوند و برهم کنش آنها با کنژوگه را ارزیابی کنیم.شکل 2 داده ها را که به صورت نمودار در امده اند نشان میدهد.
4.1.2.1
تحلیل داده ها
هر یک از ستون ها حاوی انتی ژن ثابت اما رقت های متفاوت از انتی ژن هستند.اختلاف رنگ بین ستون ها که انتی بادی نشاندار با رقت ثابت به آن اضافه شده است انعکاسی از اثر تغییر غلظت انتی ژن است.در ردیف ها که برای ارزیابی رنگ بیشینه استفاده میگردد طیفی از مقادیر وجود دارند که مشابه هستند.اینجا یک پلاتو (ناحیه هموار) است و انعکاسی از این است که انتی بادی بصورت مازاد وجود دارد. این ناحیه جایی است که هیچ کاهشی در رنگ در برابر رقت انتی ژن وجود ندارد و سطح بیشینه ای از اشباع انتی ژن است که به چاهک ها کوت شده است.بنابراین ما میتوانیم نواحی انتی ژن /انتی بادی مازاد را شناسایی کنیم. با نگاه به ردیف A :
مقادیر سایه دار شبیه هم هستند و یک پلاتو با مقدار بیشینه د رحدود 2.0 واحد OD را نشان میدهد.هیچ اثری روی رنگ در رقت های انتی ژنی 20/1 ، 40/1 ،80/1 ،160/1 ،320/1 یا 640/1(چاهکهای 1 تا 6) وجود ندارد.این نشان میدهد درحضور یک رقت ثابت انتی بادی، یک مقدار یکسان از انتی ژن چاهک ها را تا رقت 640/1 می پوشاند.به دنبال رقت های بیشتر ،کاهش در مقادیر OD در برابررقت انتی ژن وجود دارد.
توجه کنید که ردیف های B و C نتایج مشابه دارند و نشانه پلاتو است از ردیف 1 تا 6 .شکل 2 بصورت گرافیکی نشان میدهد که منحنی ها مشابه هستند اگر چه کاهش خفیفی با رقت کنژوگه دیده میشود. این نشان میدهد که انتی ژن بصورت مازاد است مخصوصا در رقتی که به ستون 5 اضافه شده است.بنابراین افزایش غلظت انتی ژن بالاتر از آنچه که در رقت 320/1 است تنها انتی ژن را به هدر میدهد.
به مقادیر OD در ستون 12 توجه کنید چون این ستون نمایانگر تشکیل رنگ در جایی است که هیچ انتی ژنی وجود ندارد.مقادیر A تا C بالا است نسبت به D تا G که پایین و یکسان هستند .این رنگ نتیجه اتصال غیر اختصاصی کنژوگه به چاهک ها است.هرچه مقدار پروتیین اضافه شده بیشتر باشد احتمال اتصال غیر اختصاصی بیشتر خواهد بود.توجه کنید که کاهش در رنگ به سمت پایین هر ستون در برابر رقت کنژوگه حتی درمازاد انتی ژن وجود دارد(ستون های 1 تا 5/6 ). این بخاطر کاهش درغلظت کنژوگه است (رقیق شدن انتی بادی های واکنشگر نشاندار با انزیم ).
برای بدست آوردن بیشترین نتایج قابل کنترل در الایزا بیشینه مقدار OD باید در حدود 1.5 تا 1.7 واحد باشد.مقادیر بالاتر از این ،از نظر دستگاهی ناصحیح هستند.بنابراین مناسب سازی، یعنی ارزیابی یک سنجش بطوری که بیشینه پلاتو نزدیک این مقادیر از OD باشد.این نتیجه مبتنی بر OPD/H2O2 است و دیگر سیستم ها مقادیر مناسب خود شان را دارند اما با هر سیستم سوبسترا / رنگزا نباید به سمت مقادیر بسیار بالای OD برویم.اجازه بدهید روی ردیف های D و E متمرکز شویم جایی با ارتفاع پلاتوی 1.8 در ناحیه ای که انتی ژن بصورت مازاد وجود دارد .
در ردیف D تیتراسیون انتی ژن وجود دارد(کاهش رنگ بیشینه در برابر رقیق شدن انتی ژن) که از ستون 5 شروع می شود و برای ردیف E از ستون 4 شروع میشود.منحنی تیتراسیونی که برای هر کدام که درشکل 2 دیده میشود به بلندی مقادیر مربوط به A تا C نیست با اینحال مقادیر پس زمینه برای هر دو پایین است (0.1OD) و مساوی است با کنترل هایی که انتی ژن یا کنژوگه ای درآن اضافه نشده است.(یعنی H 12).
با رقت بیشتر کنژوگه (ردیف های F تا H) ،چه انتی ژن بصورت مازاد و چه رقیق شده باشد کاهش مشخصی در رنگ دیده میشود. دراینجا افت در حساسیت انالایتیکی سنجش وجود دارد (توانایی در تشخیص انتی ژن ) که درکاهش ارتفاع OD پلاتو انعکاس یافته و از ناحیه زیر منحنی تیتراسیون نمایش داده شده در شکل 2 نیز مشهود است.
این یک توصیف نسبتا طولانی از یک عملیات نسبتا ساده بود.با این حال به یاد داشته باشید که در آغاز آزمایش معلوم نبود که آیا انتی ژن به پلیت متصل شده است یا آنکه انتی بادی نشاندار به انتی ژن متصل میشود. بدون رجوع به نتایج واقعی OD ،ما نتایج پلیت را میتوانیم به سرعت با چشم ببینیم و تقریبا در همان لحظه ببینیم که آیا ازمایش عمل کرده ویا اینکه نواحی مناسب کدام ها هستند . زمانی این مهم است که آزمایشات اولیه در حال انجام بوده ونسبتا کارهای زیادی برای بررسی شرایط پیچیده تر لازم است. سنجش سریع ازمایش با چشم یک مزیت مشخص است نسبت به سنجش هایی که تنها متکی بر تجهیزات است.
می توانیم نتایج را بصورت ذیل خلاصه کنیم
- انتی ژن به پلیت میچسبد ودر جایی که انتی بادی کنژوگه در تیترهای 320/1 تا 640/1 به صورت مازاد وجود دارد یک واکنش بیشینه ای را ایجاد میکند.
- رقت های کنژوگه در ردیف های A تا C خیلی قوی است و بیشینه پلاتویی که میدهد بسیا ربالا است.
- ردیف های D و E منحنی تیتراسیون خوب و یک ارتفاع پلاتوی خوب برای انتی ژن میدهد.
- اگر کنژوگه همانند ردیف های ّF و G رقیق شود کاهش در حساسیت انالیتیکی به وجود خواهد امد.
اکنون اولین ازمایش را که دیدی درباره ارزیابی الایزای مستقیم ارایه میداد کامل کردیم.در این مرحله میتوانیم ازمایش را با تغییر در رقت ریاحنت ها ویا شرایط، بسته به نتایجی که کسب شده تکرار کنیم.در مثال پیشین برای انتی ژن و کنژوگه انتی بادی نتایج خوب با فعالیت خوب بدست اوردیم.با اینحال همیشه اینطور نیست .دو مثال با نتایج ضعیف که لازم است تغییر و ارزیابی دوباره روی آنها انجام شود در ادامه میاید.
1.2.2
نتایج ضعیف
جدول 3 نتایج ازمایشی مشابه آن چیزی است که در زیر عنوان 1.14. توصیف شده است.می بینیم که نتایج خوبی در ردیف های A و B است و اینکه بعد از این رقت انتی ژن ، رنگ خیلی کمی ایجاد میشود.این مشخص میکند که انتی ژن کمی دررقتهای بیشتر از رقت درردیف B می چسبد. به نظر میرسد که کنژوگه در تشخیص انتی ژن تا ردیف های D و E مفید عمل میکند چون در جایی که انتی ژن کافی، چاهکها را پوشانده است، مقادیر OD مشابهی بدست می اید .در این مورد CBT را می توان با طیف رقتی متفاوت از انتی ژن تکرار کرد تا ناحیه بیشینیه پلاتو در حضور کنژوگه مازاد افزایش یابد.
مثال بعدی (نتایج جدول 4 را ببینید) نشان میدهد هنگامی که کنژوگه واکنش گری پایینی دارد چه روی خواهد داد.
نتایج نشان میدهد که رنگ پایینی در ازمایش داریم .کاهش سریع در رنگ در برابر رقت سرم نشاندار در ردیفهای َA به B به C و همینطور الی آخر وجود دارد.با اینحال یک پلاتو از ستون های 1 تا 5 (A تا C ) وجود دارد که نشان میدهد انتی ژن با مقدار مشابهی به این چاهکها می چسبد.در این مورد تغییری که پیشنهاد میشود این است که CBT اولیه با کوت کردن پلیتها از انتی ژن با رقت استفاده شده در ردیف 3 ( اخرین رقتی که مقدار بیشیینه پلاتو را نشان میدهد ) شروع شود و کنژوگه را با یک غلظت بیشتر برای تیتراسیون بکاربرد.با این شیوه تخمین بهتری از فعالیت کنژوگه بدست خواهد امد.
این وضعیت در سیستم های الایزای مستقیم معمول است چون تولید کنژوگه های خوب بستگی به فعالیت اختصاصی انتی بادی های نشاندار دارد که خود ناشی از عملکرد وزن انزیم چسبیده به انتی بادی های اختصاصی انتی ژن است.
کنژوگه کردن سرم های پلی کلونال معمولا منجر به اتصال اختصاصی انزیم به درصد نسبتا کمی از کل محتوای پروتیینی نمونه یعنی انتی بادی اختصاصی میشود.بقیه پروتیین هم نشاندار میشود که منجر به مشکلاتی درپس زمینه بالا میشود.
1.2.3
مقادیر OD پلاتو
رنگ بیشینه ای که در هر سنجش بدست می اید و در آن ریاجنتها بصورت مازاد است بدلایل زیر حاصل میشود.
- مقدار انتی ژنی که به صورت غیر فعال به یک چاهک می چسبد
- شمار جایگاه های انتی ژنی موجود برای اتصال انتی بادی
- تراکم اجزای انتی ژنی روی چاهک ها
- فعالیت اختصاصی کنژوگه به شکل مقدار انزیمی که به گونه های ویژه انتی بادی در کل سرم چسبیده است و به افینیتی مربوط به آنها بستگی دارد.
این عوامل بعدا مورد بررسی قرار میگیرند.با اینحال CBT تخمین سریع از امکان سنجش ها و نتایج آنها و مشکلات احتمالی در رابطه با این عوامل را میسر می سازد.
2
سیستم های پیچیده تر
بعد از ساده ترین مورد الایزای مستقیم حالتهایی را در نظر میگیریم که در آن سه جز یا بیشتر برای تیتر کردن لازم است.این ها در جدول 5 نشان داده شده است.به یاد داشته باشید که از نظر رقت تنها دو جز می تواند در هر ازمایشی تغییر کند.شاخص های ارزیابی هر یک از مراحل در CBT ، شبیه به همانهایی است که بطور گسترده در الایزای مستقیم توصیف شدند.
به یاد داشته باشید که هدف CBT برای مشخص کردن شرایط مناسب و دست یافتن سریع به طیف غلظتی کارامد از اجزای سنجش مورد نظر است.هدف این است که که ریاجنت ها را از نظر کارایی بررسی کنیم تا سنجش منتهی به یک شرایط کاملا تعریف شده برای انجام یک کار خاص شود.
سنجش های رقابتی کمی در بین این سیستم ها متفاوت هستند.این سیستم ها لازم است به شیوه ای تیترشوند که روش های رقابت یا مهار قابل انجام باشد.
2.1
الایزای غیر مستقیم
الایزای غیر مستقیم اساسا برای اندازه گیری انتی بادیهای ضد یک انتی ژن خاص از طریق تیتراسیون کامل یا یک رقت منفرد از نمونه است.بنابراین ما به سنجشی نیاز داریم که مقدار مناسبی از انتی ژن به چاهکها کوت شده و بطور موفقیت امیزی به انتی بادی ها متصل میشوند و این انتی بادی ها خود در عوض با یک مقدار مناسب از کنژوگه ضد گونه شناسایی میشوند.ما می توانیم تنها دو تا از این متغیر ها را در یک سنجش تیتر کنیم .مهمترین جنبه هایی که باید در نظر گرفته شوند 1. اینکه انتی ژن کافی برای اتصال انتی بادی موجود است ، اما دوست نداریم که با اضافه کردن غلظتهای خیلی بالا، انتی ژن را هدر دهیم طوری که چاهکها نسبت به مقدار لازم برای پر کردن مکانهای موجود پلاستیک آنتی ژن اضافی دریافت کنند. 2.اینکه مقدار مناسب از کنژوگه داریم طوریکه از پس زمینه های غیر اختصاصی پیش گیری کرده وتشخیص تمام مولکولهای انتی بادی متصل شده انجام شود و حساسیت انالیتیکی مورد نیاز هم تامین گردد. همچنین نیاز داریم تا اثر سرم های منفی رقیق کننده (از همان گونه ای که نمونه های مورد ازمایش است) را روی سنجش ارزیابی کنیم تا داده هایی در رابطه با پس زمینه های ممکن چنین سرم هایی در رقت های مختلف داشته باشیم.بنابراین می توانیم نیازهای این طراحی را به شرح زیراصلاح کنیم:
- ما نیاز به مقدار کافی انتی ژن داریم که به چاهک ها بچسبد و انتی بادی ها را به دام بیاندازد.
- ما حداقل به یک سرم مثبت برای انتی ژن نیاز داریم
- ما حداقل به یک سرم منفی از گونه یکسان با نمونه های مورد ازمایش نیاز داریم
- ما به کنژوگه ضد گونه نیاز داریم
2.1.1
CBT اولیه
ازمایش اولیه باید یک CBT ازرقت های انتی ژن در برابر سرم های مثبت و منفی با استفاده از یک کنژوگه تجاری رقیق شده در سطح توصیه شده باشد.با این حال براورد ازمایشگاه شخصی از تیترهای مناسب کنژوگه های ضد گونه با استفاده از الایزای مستقیم به راحتی به دست میاید. یا سرم کامل از گونه حیوانی هدف یا بخشی از یک سرم (مانندIgG )می تواند برای کوت کردن پلیت ها در مرحله (i) در الایزای مستقیم استفاده شود.وقتی که سرم کامل استفاده میشود رقت اولیه 200/1 در ردیفهای 1 تا 11 استفاده شود.در استفاده از IgG میتوان وزن آن را با روش اسپکتروفتومتری سنجید و با غلظت 10 ug/ml شروع کرد.
مرحله دوم شامل رقیق کردن کنژوگه در بافر مسدود کننده است .تخمین مقدار مناسب کنژوگه پیشتر توصیف شد. رقتی که بیشینه پلاتویی در حدود 1.8 واحد با یک منحنی تیتراسیون خوب ارایه میدهد باید در الایزای غیر مستقیم استفاده شود.رقت استفاده شده بعدا با بررسی نتایج تیتراسیون میتواند تغییر کند.این کار ممکن است لازم باشد چون ماهیت دقیق و غلظت ایمونوگلوبولین های اختصاصی که در الایزای غیر مستقیم به انتی ژن (ها)ی اختصاصی متصل میشود ممکن است با آنهایی که در سرم یا فراورده های سرمی وجود دارد متفاوت باشد.
2.1.2
مرحله (i) از CBT الایزای غیر مستقیم
شکل 3 مرحله (i ) از CBT الایزای غیر مستقیم را نشان میدهد.این مرحله انتی ژن را بر ضد سرم ها ی مثبت و منفی تیتر میکند و می تواند به عنوان تمرینی که به ما یک دید میدهد در نظر گرفته شود.به یاد داشته باشید که شرایط می تواند در تکرار CBT تغییر کند.نتایج به طور نمونه در جدول 6 امده است.
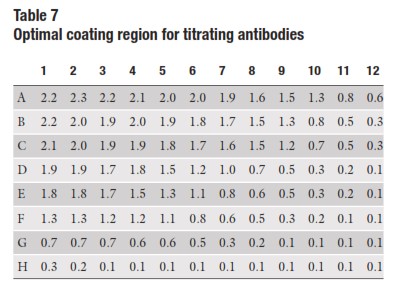
در این مثال ما تیتراسیون انتی ژن را از 50/1 به صورت دوبرابری و تیتراسیون سرم را از 051/ بصورت دوبرابری استفاده کرده ایم.کنترل ها در این ازمایش در ستون 12 نشان داده شده اند که فاقد انتی ژن اما حاوی یک طیف رقتی از انتی بادی هستند و ردیف H که حاوی یک طیف رقتی از انتی ژن اما فاقد انتی بادی است.داده ها به عنوان نتایجی خوب درنظر گرفته میشوند چون رنگ در سطحی بالا ایجاد شده و تیتراسیون مربوط هم به موازی کاهش انتی ژن یا انتی بادی خوب است .ناحیه خاکستری رنگ در جدول 7 نشاندهنده جایی است که مقدار مناسب از انتی ژن کوت کننده اجازه میدهد انتی بادی ها تا بیشترین حد تیتر گردند.
بنابراین انتی ژن را میتوان تا سطح موجود در ستونهای 5 و 6 ،قبل از اینکه کاهشی در رنگ باشد رقیق کرد.توجه کنید بیشینه ارتفاع پلاتو به ویژه بعد از ردیف E کاهش می یابد که مشخص میکند کاهش در اتصال انتی بادی ها بخاطر کاهش در مقدار انتی ژن کوت شونده به چاهکها اتفاق افتاده است.
بررسی ستون 12 نشان می دهد که در غیاب انتی ژن ، سرم مثبت در رقتهای 1/50 ، 1/100، و 1/200به پلیت متصل میشود که تولید پس زمینه میکند.
این یک نمونه نوعی از سرم درالایزای غیر مستقیم است و چنین پس زمینه غیر اختصاصی هنگام غربالگری نمونه های مورد ازمایش در رقتهای منفرد درالایزای غیر مستقیم باید در نظر گرفته شود ،چون حساسیت انالیتیکی سنجش تحت تاثیر قرار میگیرد.همان رنگ درتیتراسیون سرم منفی (جدول 8) ایجاد میشود که مشخص میکند این پس زمینه از برهم کنش پروتیین های موجود در سرم ریشه میگیرد.
جدول 8 نتایج تیتراسیون سرم منفی را ارایه میدهد .بطور کلی تشکیل رنگ بسیار پایین تری در غیاب انتی بادی برای اتصال به انتی ژن مورد انتظار است .
با اینحال مقداری رنگ در حالتهای ترکیبی مختلف به ویژه هنگامی که غلظتهای سرم منفی بالا است وجود دارد.این رنگ بخاطر چسبیدن غیر اختصاصی اجزای سرم از گونه حیوانی مورد ازمایش است .بنابراین لازم است که پس زمینه ارزیابی شود و هنگام تیتراسیون دوباره کنژوگه آنطور که در مرحله (ii) توصیف شده ، پس زمینه دوباره بررسی گردد.همانطور که مشخص شده در A12 رنگ وجود دارد و تقریبا به شدت آنچه که در A1 دیده میشود است.مورد اخیر حاوی انتی ژن است و مشخص میکند که افزایش کمی در اتصال وجود دارد اگرچه زیاد بزرگ نیست.رقت های سرمی 1/50 و 1/100مقداری پس زمینه نشان میدهند و همانطور که مشخص شد بخاطر برهم کنش پروتیین های سرم با پلیت بصورت غیر اختصاصی است .شکل 4 داده ها را برای سرم های مثبت و منفی ترسیم میکند.
2.1.3
مرحله (ii) از CBT الایزای غیر مستقیم
از CBT اولی ما می توانیم رقت انتی ژن را با تشکیل یک رنگ خوب در نتیجه اتصال با انتی بادی تخمین بزنیم .از آنجایی که دوست نداریم انتی ژن را با اضافه کردن بیش از حد ( که در مرحله کوتینگ شسته می شود) به هدر بدهیم میتوانیم رقت اخر انتی ژن را انتخاب کنیم که منحنی تیتراسیون خوبی برای انتی سرم میدهد( به عبارت دیگر بیشینه ارتفاع پلاتو و نقطه انتهایی بالا).جدول 7 مشخص میکند که ستون های 5 و 6 انتی ژن کافی را داراست تا این شاخص ها را تامین کند.بنابراین چاهکها با این رقت منفرد می توانند کوت شوند و انتظار میرود که سرم مثبت با یک بیشینه OD ( که در آن انتی بادی ها بصورت مازاد است ) تقریبا برابر با 2.0 ، تیتر خواهد شد و اینکه انتی بادی ها نیز تا ردیف G ( در برابر رقیق شدن) قابل تشخیص خواهند بود.
تیتراسیون سرم ها
در تیتراسیون سرم ها طیف رقتی سرم مثبت آنچنان وسیع نیست تا تیتراسیون انتی بادی ها را بتوان تا نقطه انتهایی (جایی که OD با وجود انتی بادی ها برابر با پس زمینه است) انجام داد.
این مورد را میتوان با تغییر در طیف رقت انتی سرم مثبت در مرحله (ii) بیشتر بررسی کرد.
با فرض اینکه ما رقت انتی ژن را همانطور که در ستون 5 است در نظر بگیریم آنگاه اولین کار در مرحله (ii) شامل موارد زیر است :
- چاهکهای دو پلیت را با رقتی از انتی ژن برابر با آنچه که در ستون 5 (1/800) است کوت کنید . به مدت زمان مرحله (i) اینکوبه کنید . چاهکها را بشویید.
- یک طیف رقتی از انتی سرم مثبت و منفی آنطور که در مرحله (i) استفاده شده اضافه کنید.چاهکها را اینکوبه کنید و بشویید.در اینجا همانطور که قبلا مشخص شد ما میتوانیم طیف را تغییر دهیم چون در مرحله (i) نقطه انتهایی سرم مثبت را پیدا نکردیم به این دلیل که طیف خیلی محدودی از رقت ها را استفاده کرده بودیم.می توانیم طیف را به یکی از سه روش زیر افزایش دهیم.
- رقیق کردن سرم که از ستون 1 شروع میشود وتا ستون 11 ادامه میابد.
- شروع با یک رقت اولیه بالاتر مانند 1/200
- تغییر طیف رقتی به سه برابر (نسبت به دوبرابر)
بهترین روش این است که در ارتباط با CBT اولیه ارزیابی انجام شود.هنگامی که طیف رقتی خیلی پایین است و رنگ بالایی درسراسر پلیت بدست امده است با این مشخصه که تنها ،تیتراسیون در دو ردیف اخر است ، پس استفاده از یک طیف سه برابری رقت توصیه میشود.
در مثال حاضر رقت سرم مثبت از 1/50شروع و در سری هفت چاهکی به صورت دو برابر رقیق شد .بنابراین ما رقتهای 1/50، 1/100، 1/200، 1/400، 1/800، 1/1600و 1/3200را داریم.در رقت اخر ما نقطه انتهایی را بدست نیاورده ایم و با بررسی منحنی می توانیم حدس بزنیم که حداقل چهار مرحله رقت مشابه نیاز خواهد بود تا رنگ به حد پس زمینه کاهش یابد(بخاطر اینکه انتی بادی ها رقیق شده اند).بنابراین در مرحله (ii) ما میتوانیم پلیت کوت شده را بکار ببریم و سرم مثبت را از 1/50{ همانند مرحله (i) } با 11 گام تا 1/51200با استفاده از ستونهای 1 تا 11 رقیق کنیم .
تیتراسیون کنژوگه ضد گونه
در محله (i) ما رقت کنژوگه مناسب را یا از اطلاعات داده شده توسط روش ها یا از CBT اولیه کنژوگه در برابر سرم کوت شده داخل چاهک ها براورد کرده بودیم.تیتراسیون کنژوگه دراین مرحله بررسی فعالیت آنرا تحت شرایط کامل الایزای غیر مستقیم و نیز اصلاح دوباره رقت آنرا میسر میسازد تا حساسیت انالیتیکی را با شناسایی ناحیه هایی که کنژوگه مازاد پس زمینه بالا ایجاد میکند به بالاترین حد برسانیم.
- یک طیف رقتی دو برابری از کنژوگه را از ردیف A تا H اضافه کنید.اینکوبه کنید و سپس بشویید. در این جا نیز فرصت اصلاح رقت شروع را برپایه نتایج حاصل از مرحله (i) داریم .اگر از توصیه شرکت تجاری تولید کننده استفاده میشود کار خوب این است که رقت کنژوگه را با چهار برابر بیشتر از آنچه که توصیه شده است شروع کنید و حداقل تا چهار برابر پایین تر رقیق کنید.به عنوان مثال رقت توصیه شده 1/2000است پس کنژوگه باید از 1/500به صورت گام های دو برابری تا 32000 تیتر شود.وقتی یک CBT اولیه ضد سرم مربوط وجود دارد پس همان روش باید نزدیک همان مقدار مناسب پیدا شده ابتدایی انجام شود.
- رنگزا /سوبسترای مربوط را به سیستم اضافه کنید و اینکوبه کنید
- واکنش را همانند مرحله (i) متوقف کنید و OD را در اسپکتروفتومتر بخوانید.
2.1.4
نتایج
جدولهای 9 و 10 نتایج CBT ها را نشان میدهد.جدول 9 نشان می دهد که یک پس زمینه 0.5 در ردیف A و ستون 12 وجود دارد.در این ردیف، کنژوگه 1/500استفاده شده که نشان می دهد کنژوگه به انتی ژن کوت شده به پلیت بطورغیر اختصاصی متصل میشود.این یافته در جدول 10 تایید میشود چون مقدار پس زمینه در برابر رقیق شدن سرم منفی از A2 تا A12 همچنان برقرار مانده است .اگرچه این ها نتایج ایده الی هستند اما مثالی از پدیده ای معمول هستند.پس زمینه در ردیف B کاهش یافته است (رقت کنژوگه 1/1000در مقایسه با مقدار ستون 12 از جدول 9)،اما جدول 10 نشان میدهد هنوز یک پس زمینه بالایی در B3 تا B12 وجود دارد و نشاندهنده اتصال غیر اختصاصی است.
در ردیف C ، در هر دو پلیت پس زمینه در ستون 12 پایین است (0.1) و در بقیه رقتهای کنژوگه ثابت باقی میماند .این مقدار را میتوان به عنوان کمترین پس زمینه برای ازمایش (پس زمینه پلیت ) در نظر گرفت.جدول 9 نشان می دهد که تیتراسیون خوبی از سرم در ردیف C وجود دارد با یک پلاتو (ناحیه با بیشینهOD) و حاکی از یک ناحیه مازاد انتی بادی.
بنابراین کنژوگه در رقت موجود در ردیف C ((1/2000 انتی بادی های متصل شده را تشخیص داده و نتایج OD مناسبی بدست میاید .نقطه انتهایی( در مقایسه با به OD بدست امده در غیاب سرم (C12) ) بدست نیامده است اما کاهش تدریجی در OD در برابر رقیق شدن سرم ( منحنی تیتراسیون)مشاهده میشود.این نتیجه با نتایج ایده ال برای ردیف C در جدول 10 مخالف است .در اینجا هیچ تیتراسیونی در هیچ رقتی از سرم منفی دیده نمی شود.
کاهش غلظت کنژوگه ضد گونه دو پیامد دارد.یکی این که رنگ بیشینه پلاتو کاهش می یابد و دیگر اینکه نقطه انتهایی تیتراسیون به طور موثری کاهش می یابد.بنابراین در جدول 9 ما کاهش کوچکی در پلاتوی ردیف D می بینیم که وقتی بیشتر رقیق میکنیم برجسته تر میشود.
تا ردیف G ما یک OD پایین داریم حتی جایی که اتصال کافی انتی بادی برای ایجاد سیگنالی قوی در حضور انتی بادی مازاد وجود دارد(آنطور که در A تا D و ستون های 1 تا 4/5 دیده میشود).رقت مناسب کنژوگه دراین مرحله از ارزیابی رنگ بیشینه پلاتو و نقطه انتهایی تیتراسیون در مقایسه با پس زمینه کنترل نتیجه گیری میشود.در این مورد یک رقت کنژوگه 1/2000 تا 1/4000 با رقتهای سرمی استفاده شده، مناسب به نظر میرسد.دراین رقت هیچ OD در سرم منفی اندازه گیری نشد.
نسبتهای اتصال
روش دیگر بررسی نتایج این است که نسبتهای اتصال (binding ratio) تیتراسیون های مثبت و منفی را محاسبه کنیم.این کار به راحتی از تقسیم مقدار OD برای رقت مفروض سرم مثبت بر مقدار مربوط به سرم منفی به دست میاید.جدول 11 نسبتهای اتصال را برای داده های جدول 9 و 10 ارایه میدهد.این فرایند ،تصویر روشن تری از بهترین شرایط را هنگام طراحی سنجش ها ارایه میدهد و ویژگی است که هنگام استفاده ازمایشات تشخیصی بکار میرود.
جدول 11 بالاترین نسبتهای اتصال را در ردیف های C و D نشان می دهد علی رغم اینکه مقادیر OD برای سرم مثبت در A و B بیشتر است.این بدلیل مقادیر OD نسبتا پایین برای سرم منفی در رقتهای بالاتر کنژوگه است .توجه داشته باشید که نسبتهای اتصال در 1/50 و 1/100 از سرم مثبت در در A1 و B1 و 2 پایین تر از چاهکهای بعدی است .این امری طبیعی است و نتیجه اتصال غیر اختصاصی بالا در این رقتها درسرم منفی است.در حقیقت این اثری معمول است و در عمل بدتر از این ها اتفاق میافتد.
در تفسیر بهترین شرایط با این روش باید دقت کرد چون در جایی که مقادیر OD اتصال در سرم منفی بی نهایت پایین است، مقادیر پایین OD برای سرم های مثبت نیز نتایج خوبی میدهد.با اینحال هر چه مقادیر OD مورد بررسی پایین تر باشد تغییرات درنتایج نیز بیشتر خواهد بود و بنابراین بین مقادیر بالای نسبتهای اتصال و مقادیر OD برای سرم مثبت ارتباط منطقی ضروری است.با این شیوه ارزیابی نقطه انتهایی را نیز می توان انجام داد. اخرین رقتی از سرم که نسبت اتصال بیشتر از 1.0 بدهد را می توان به عنوان نقطه انتهایی در نظر گرفت.
در مثال ما نقاط انتهایی برای رقتهای مختلف کنژوگه بصورت یک خط در جدول 12 نشان داده شده است.دراینجا می بینیم که رقیق کردن کنژوگه سبب کاهش نقاط انتهایی میشود(E تاG ) . اگرچه از بررسی داده های نسبت اتصال مشخص است که رقت کنژوگه در C بیشترین حساسیت انالیتیکی را میدهد چون نسبت اتصال در رقت موجود در ستون 10 ،درمقایسه با دیگر نتایج برابر با 4 است ، با این حال نقطه انتهایی در B تا D پیدا نشده است.تنها کنترل هایی که بحث نشده اند کنترلهای ردیف H هستند.این ها چاهکهای کوت شده با انتی ژن هستند (ثابت ) با رقتهای انتی بادی 1/50 دو برابر اما بدون هیچ کنژوگه .در این مثال با نبود کنژوگه مقداری رنگ در چاهکهای سرم مثبت 1/50 و 1/100 وجود دارد.
این مساله درالایزای غیر مستقیمی که نمونه ها را با یک رقت ازمایش میکند ، براورد رقت سرمی را تحت تاثیر قرار میدهد.این اثر درسرم مثبت 1/200 محو شده و برای سرم منفی قابل مشاهده نیست.
2.1.5
نتیجه گیری
اگرچه استفاده از CBT فرایند پر زحمتی است اما اصول ساده ای دارد.درابتدا انتی ژن در برابر انتی سرم با استفاده از یک رقت کنژوگه براوردی تیتر شد. مشخص شد که تفاوت قابل ملاحظه ای در OD بدست امده برای دو سرم وجود دارد.غلظت تقریبی انتی ژن که پلیت ها را کوت میکند ، تعیین شده و برای ارتباط رقت های انتی سرم ها و کنژوگه مورد استفاده قرار گرفت.بنابراین موارد زیر را می توانیم نتیجه بگیریم.
- انتی ژن می تواند دررقت 1/800 استفاده شود.
- کنژوگه می تواند از 1/2000 تا 1/4000 استفاده شود
- با این شرایط جداسازی خوبی بین سرم مثبت از سرم منفی وجود دارد و رقت سرمی 1/400 برای ازمایش نمونه ها با یک رقت پیشنهاد می شود.
2.1.6
طراحی الایزای غیرمستقیم
آزمایشهایی که اینجا توصیف شدند طی دو روز قابل انجامند و اصلاح های بیشتر را میتوان با استفاده از ریاجنتها در ازمایش های دیگر با اندکی تغییر در رقتها ارزیابی کرد.همانند دیگر الایزا ها ضروری است که هدف نهایی ازمایش مورد توجه قرار گیرد.
در مواردی که ازمایش قرار است برای غربالگری مثبت بودن صدها یا هزاران سرم بر پایه یک رقت (بصورت دوتایی یا سه تایی) انجام شود مرحله تیتراسیون باید به اندازه ای کار شود تا عوامل ذاتی در بررسی یک جمعیت متغیر از انتی سرم ها شناسایی شود.مثال قبل روی استفاده از یک سرم مثبت یا منفی تمرکز کرده بود . قصد آن نیست که تفاوت های جمعیت سرمی مورد ازمایش انعکاس یابد.بنابراین در مرحله ای که رقت کاری انتی ژن و کنژوگه را در اختیار داریم، سرم های مثبت و منفی بیشتری را ( اگر ممکن باشد) باید بگنجانیم تا عوامل مناسب سازی حساسیت انالیتیکی را بیشتر ازمایش کنیم. آنگاه مساله، ارزیابی این عوامل خواهند بود.
- که ایا انتی ژن مناسب سازی شده برای تعداد سرم های منفی و مثبت کافی است
- رقت انتی سرمی مناسب برای استفاده در غربالگری نمونه منفرد چیست.این مساله حاصل رسیدن به تعادل بین بیشینه حساسیت انالیتیکی و بیشینه اختصاصیت است.
- مقدار میانگین OD جمعیت سرم منفی (و تغییرات آن)چقدر است .این شاخص ، میزان مثبت بودن را با حدود اطمینان مختلف و تغییرات آن نشان میدهد.
الایزای غیر مستقیم ممکن است به صورت سنجش رقابتی یا مهاری استفاده شود.در این موارد مشکل ، غربالگری سرم های مثبت از نظر ویژگی هایی است که آنها را با زمینه مورد مطالعه بهتر مرتبط میسازد و یا در رابطه با سرم های مورد ازمایش از نظر جمعیت انتی بادی است که با شاخصهای اختصاصی روی انتی ژن مورد نظر واکنش می دهند.ممکن است لازم باشد تا شماری از سرم های مثبت را تحت شرایط سنجش غربالگری کرد تا یک سرم منفرد را با بهترین ویِژگی ها شناسایی نمود.
الایزای غیرمستقیم همچنین یک روش نسبتا اسان و سریع تیتراسیون نقطه انتهایی برای بسیاری از سرم ها را ممکن میسازد.تیتراسیون های نسبتا ساده میتواند اعتمادی در رابطه با ویژگی های سرم ها که ممکن است در دیگر ازمایش ها استفاده شوند ارایه دهد. (بعنوان مثال میتوانند مثبت یا منفی بودن را تایید کنند).این مساله در اینده در مثالهای استفاده شده از الایزای غیرمستقیم بررسی میشود.
2.2
الایزای ساندویچ مستقیم
الایزای ساندویچ مستقیم یک سنجش سه جزی است .ما باید موارد زیر را تیتر کنیم.
- انتی بادی گیرنده
- انتی ژنی که به دام می افتد
- کنژوگه تشخیص دهنده
تنها دو جز می تواند در هر ازمایش تغییر کند بنابراین همان معیارها که در الایزای غیر مستقیم مشخص شد، قابل استفاده است.احتمالا بیشترین جزئ قابل تغییر در این سنجش فعالیت کنژوگه نشاندار است که معمولا در ازمایشگاه طراحی کننده سنجش تهیه می شود.چنین کنژوگه هایی بخاطر مقدارانزیمی که به انتی بادی های اختصاصی درون یک سرم پلی کلونال تولید شده علیه انتی ژن می چسبند می تواند ویژگی هایی کاملا متفاوت داشته باشند.بنابراین هیچ فرضی ،آنطور که در مورد کنژوگه های ضد گونه از منابع تجاری وجود دارد در رابطه با فعالیت این نوع کنژوگه ها نمی توان داشت و تیتراسیون های اولیه احتمالا نیازمند چرخه های بیشتری است تا غلظت مناسب بدست اید.
2.2.1
کمک ها در طراحی سنجش ها
در طراحی چنین سنجش هایی استفاده از الایزاهای غیر مستقیم در ارزیابی ارتباط اتصال انتی ژن و انتی بادی میتواند کمک کننده باشد.با این حال برای طراحی یک الایزای ساندویچ (از انتی بادی روی چاهکها به عنوان ریاجنت برای به دام اندازی آنتی ژنها استفاده میشود) معمولا نیاز به تغلیظ انتی ژن ضعیف (نامناسب برای الایزای غیر مستقیم ) یا به دام انداختن یک جز خاص از یک مخلوط انتی ژنی می باشد.انتخاب یک انتی سرم برای نشاندار کردن و کنژوگه کردن برای استفاده در الایزای ساندویچ می تواند مبتنی بر براورد تیتر تعدادی از سرم ها در الایزای غیر مستقیم با شرایطی که انتی ژن به مقدار کافی کوت شده ، باشد.بنابراین سرم های با تیتر بالا شناسایی میشوند .چنین تیتراسیون هایی را می توان با دیگر روش ها انجام داد که منتهی به انتخاب سرم هایی با بالاترین فعالیت می شود.
2.2.2
مرحله (i)
تیتراسیون انتی بادی گیرنده و انتی ژن
شکل 5 نمای مرحله (i) از الایزای ساندویچ مستقیم را نشان میدهد . که سرم کامل به عنوان ریاجنت به دام اندازنده و یک رقت 1/100 در ستون 1 استفاده میشود.وقتی IG (به عنوان مثالIgG ) از انتی سرم تهیه شد غلظت پروتیین را می توان به راحتی از طریق خوانش جذب در یک اسپکتروفتومتر فرابنفش تعیین کرد.در این مورد یک غلظت اغازین 10 ug/ml باید استفاده شود ( ما هنوز حجم 50 ul را به عنوان مقدار ثابت در این مثال استفاده میکنیم ) .
در این سطح از پروتیین ، چاهکها اشباع خواهند شد طوری که فعالیت انتی بادی گیرنده متکی بر غلظت نسبی انتی بادی های اختصاصی در بخش IgG در مقایسه با دیگر مولکولهای IgG در سرم است.اضافه کردن هر غلظتی بیشتر از این،سبب هدر رفت است و توانایی به دام اندازی ریاجنت کوت کننده را بهتر نمیکند.طیف رقت سازی باید دو برابری باشد و سرم تا ستون 11 باید رقیق شود.رقیق کننده معمول برای انتی بادی ها PBS pH 7.2 یا کربنات /بیکربنات با pH 9.6 است .
بعد از اینکوباسیون ( مثلا 1 تا 2 ساعت در 37 درجه ) چاهک ها شسته می شوند.سپس انتی ژن از ردیف A تا ردیف G رقیق میشوند.وقتی که هیچ اطلاعاتی از دیگر سنجش ها در رابطه با غلظت احتمالی انتی ژن وجود ندارد آنگاه طیف رقت باید از 1/50 شروع شود.
در این جا فرض بر این است که یک حجم کافی از انتی ژن برای انجام چنین رقتی وجود دارد.هنگامی که حجم خیلی کمی از یک انتی ژن با غلظت نامعلوم وجود دارد آنگاه باید تصمیم بگیرید که ایا انتی ژن کافی برای طراحی ازمایش وجود دارد یا اینکه انتی ژن دارای غلظت بالا هست و اینکه رقت 1/50 برای تیتر شروع کننده کافی خواهد بود.نتایج مرحله (i) مشخص خواهد کرد که ایا انتی ژن دارای غلظت بالا است یا پایین.برای رقت 1/50 با حجم 50 ul ما به اندازه 12 چاهک با رقت 1/50 برای ردیف A به اضافه 12 چاهک با رقت 1/50 برای رقیق سازی در ردیف B ( در کل 1200 ul=1.2 ml ) برای ازمایش نیاز داریم .این برابر با 24 ul از انتی ژن رقیق نشده برای مرحله (i) از CBT می باشد.بخاطر داشته باشید که کمی حجم اضافه تر از آنچه که بطور دقیق نیاز است تهیه کنید.بنابراین اگر 30 میکرولیتر انتی ژن درul 1500 رقیق شود یک حجم واقعی تر خواهد بود.انتی بادی در یک بافر مسدود کننده مناسب رقیق می شود تا از اتصال غیر اختصاصی پروتیین ها به چاهکها پیش گیری شود .بعد از اینکوباسیون و شستشو یک رقت ثابت از از سرم نشاندار تشخیص دهنده اضافه میشود . از آنجایی که ما هیچ نظری در رابطه با فعالیت موثر نداریم پس کنژوگه را با رقت 1/200 اضافه کنید.بنابراین ما نیاز به حجم 96 چاهک ضرب درul 50 =ul 4800 و تقریباul 5000 (0.5 ml) نیاز داریم تا مقداری برای هدررفتها در نظر گرفته باشیم.این به این معنی است که ما/200 ul 5000 از کنژوگه رقیق نشده برای یک پلیت در مرحله (i) =ul 25 نیاز داریم .محاسبات در اینجا اورده شد تا به کاربران خاطر نشان کند که به موجود بودن ریاجنتها توجه کنند .بعد از اینکوباسیون محلول رنگزا/سوبسترا اضافه میشود و تشکیل رنگ با یا بدون متوقف کننده (بستگی به سیستم دارد) خوانده میشود.
نتایج مرحله (I)
جدول 13 مثالی از نتایج خوب را نشان میدهد.ستون ها دارای رقتهایی از سرم گیرنده و ردیف ها دارای رقتهایی از انتی ژن به دام افتاده است.ردیف A دارای بالاترین مقدار انتی ژن است و بررسی مقدارهای OD نشان میدهد که یک پلاتویی از مقدارهای OD از ستون 1 تا 4 وجود دارد.این نشان میدهد که سرم تشخیص دهنده بصورت مازاد است و اینکه انتی ژن کافی برای ایجاد سیگنال قابل ملاحظه وجود دارد (1.9 واحدOD).یک پلاتوی مشابه در ردیف B مشاهده میشود که مشخص میکند رقیق سازی انتی ژن هیچ تاثیر قابل ملاحظه ای روی تیتراسیون سرم ندارد.داده ها ی A و B یکسان هستند و مشخص میکنند که مقدار یکسانی از انتی ژن دراین ردیف ها به دام افتاده است.
ردیف C یک مقدار OD پلاتوی کاهش یافته ای را نشان میدهد اما حد پلاتو ( تا ستون 4) همانند A و B است.این کاهش مشخص میکند که یک کاهش خفیف در مقدار انتی ژن به دام افتاده وجود دارد.این اثرهمچنین در بررسی کامل مقدارهای طیف تیتراسیون اشکار است با این حال OD پس زمینه (ستون 12)در C کمتر (0.05) نسبت به A و B (0.1) است .ادامه کاهش در غلظت انتی ژن (D تاG) توانایی سرم تشخیص دهنده که تیتر میشود بیشتر افت میکند تا جایی که هر دوی بیشینه ارتفاع پلاتو و نقاط انتهایی بطور قابل ملاحظه ای کاهش میابند.این داده ها را می توان بصورت نسبتهای اتصال بیان کرد که مقدارهای در حضور سرم را با مقدارهای کنترل در ستون 12 مرتبط میسازد.جدول 14 این مقادیر را نشان میدهد.
بررسی نسبتهای اتصال ،مزیت استفاده از انتی ژن را در غلظتهای پایین تر از آنچه که برای به دست آوردن بیشینه OD استفاده میشود برجسته میکند چرا که مقادیر پس زمینه ( انتی ژن به اضافه کنژوگه به تنهایی) در این حالت پایین تر هستند.از داده های جداول 13 و 14 میتوانیم براورد کنیم که رقت مناسب انتی ژن باید همانی باشد که در ردیف C استفاده شده و رقت مناسب انتی بادی گیرنده همانند آنچه که در ستون 4 است باید باشد.این در جدول 14 برجسته شده است. فرض کنید رقیق سازی سرم گیرنده را با 1/200 شروع کردیم و انتی ژن را با 1/50 بنابراین مقدارهای مناسب را برای هر کدام 1/1600 ( سرم ) و 1/200 ( انتی ژن ) خواهد بود.
2.2.3
مرحله (ii)
تیتراسیون انتی ژن و انتی بادی نشاندار
ما اکنون غلظت یکی از واکنشگرها را ثابت نگه میداریم . مرحله (i) از رقت ثابت سرم تشخیص دهنده نشاندار (1/200) استفاده کرد که نتایج خوبی داد.با اینحال لازم است تیتر مناسب این ریاجنتها را بدانیم تا یک منبع با ارزش هدر نرود(با تحت براورد داشتن غلظت ) و اثر آنرا بر حساسیت نهایی سنجش بررسی کنیم.هدف این است که رقت کنژوگه را در تشخیص انتی ژن به دام افتاده مناسب سازی کنیم.
مرحله (ii) شامل کوت کردن پلیت ها با یک مقدار ثابت بدست امده از مرحله (i) از سرم به دام اندازنده است (برابر با رقت در ستون 4 = 1/1600).
بعد از اینکوباسیون و شستشو ، انتی ژن با یک طیف رقتی دو برابری از یک مقدار دو تا چهار برابر بالاتر از آنچه که در مرحله (i) بدست امده ، از ردیف A تا G اضافه میگردد.بعد از اینکوباسیون و شستشو کنژوگه تشخیص دهنده از ستون 1 تا 11 از یک رقت دو تا چهار برابر بالاتر از آنچه که در مرحله (i) استفاده شد یعنی از 1/50 تا 1/100 رقیق میشود.بعد از اینکوباسیون و شستشو و اضافه کردن سوبسترا / رنگزا ازمایش خوانده میشود . جدول 15 داده های خوبی را نشان میدهد.
با رجوع به ردیفهای جدول 15 می بینیم که در کنژوگه 1/50 یک محدوده تیتراسیون خوب از انتی ژن داریم اما پس زمینه بالایی وجود دارد(0.4) .نتایج مشابهی را در ردیفهای B تا D داریم که مشخص میکند کنژوگه تشخیص دهنده بصورت مازاد است تا اینکه رقت استفاده شده به ردیف D برسد.همچنین توجه کنید که یک پس زمینه پایین تری (ستونD12 ) نسبت به C12 و B12 وجود دارد.با رقیق سازی بیشتر (ردیفهای E تاG) ارتفاع پلاتو و نقاط انتهایی را در تیتراسیون انتی ژن از دست میدهیم.دوباره نسبتهای اتصال را میتوان تهیه کرد و غلظت انتی ژن را به غلظت کنژوگه مرتبط ساخت و اثر اختلافات مشاهده شده در پس زمینه را روشن کرد(جدول 16) . داده ها مشخص میکند که رقت مناسب کنژوگه برای استفاده در تشخیص انتی ژن موجود، برابر با مقداری است که در ردیف D (1/400) دیده میشود .رقت در ردیفE (1/800) نتایج کاملا مشابهی دارد و می توان هنگامی که موجودی کنژوگه مساله ای جدی است در تشخیص انتی ژن استفاده کرد.
4.2.2.4
اصلاحات بیشتر
مراحل (i ) و (ii) براورد خوبی از غلظتهای هر یک از واکنشگرها را مشخص میکند.مثال خوب وقتی است که ازمایشها خوب کار کنند.حتی در اینجا ممکن است ما CBT های بیشتری نیاز داشته باشیم تا شرایط را دقیقتر برقرارکنیم برای مثال CBT از رقتهای انتی بادی گیرنده ضد انتی ژن ثابت و رقتهایی از کنژوگه را می توان بررسی کرد.
CBT های اولیه فرصت خوبی است برای مطالعه های محدود روی نمونه های مورد ازمایش.بنابراین اگر شما میخواهید انتی ژن را در نمونه ها تیتر کنید می توانید پلیت ها را با انتی بادی کوت کنید و سریالی از رقتهای انتی ژن مورد ازمایش را اضافه کنید و سپس این ها را با کنژوگه شناسایی نمایید.این کار مشخص میکند که تا چه اندازه نمونه های مرتبط با موضوع درست کار میکنند و احتمالا کلید هایی در رابطه با نیاز به اصلاح شرایط ارایه میدهد.
تیتراسیون این سه واکنشگر استفاده از آنها را در سنجش های مشابه با دیگر ریاجنتها مقدور میسازد.بنابراین ممکن است بخواهیم که انتی ژن دیگری را در سنجش بررسی کنیم.سرم گیرنده و کنژوگه تشخیص دهنده را میتوان در همان رقتهای مشخص شده از CBT ها استفاده کرد اما انتی ژن جدید تیتر میشود.بطور مشابه دیگر فراورده های انتی بادی گیرنده میتوانند در ازمایش هایی استفاده شوند که انتی ژن و کنژوگه با رقتهای مناسبت شده در CBT های قبلی بکار میروند.
همانطور که در الایزای مستقیم گفته شد منظور از طراحی سنجش باید همیشه قویترین عامل در مناسب سازی ریاجنت های سنجش باشد. در اخر اینکه سنجش باید ثابت کند که روی نمونه های ویّژه و تحت شرایط خاص عمل میکند و اعتبار بخشی الایزاها باید به چنین شرایطی برسند.
2.2.5
نتایج بد
یک مثال عالی نتایج خوبی را به نمایش میگذارد که در آن تمام واکنشگرها خوب عمل میکنند یعنی در رقت بالا استفاده میشوند و مقادیر OD نسبتا خوبی میدهند.وقتی غلظت یک یا چند واکنشگر پایین است یا ویژگی های اتصالی ضعیفی در سنجش دارد ،مشکلات خیلی زود جایی خود را در CBT نشان میدهد.
اگر چه تعداد مثالها نمی تواند جامع باشد ولی تشریح تعداد کمی نتایج بد نسبت به ارایه حالتهای عالی احتمالا خیلی بیشتر اگاهی دهنده است.
رنگ پایین عمومی در سراسر پلیت
جدول 17 نتایج یک CBT مشابه با مرحله (i) از الایزای ساندویچ مستقیم را نشان میدهد ( نتایج در جدول 13 نشان داده شده است).
بطور کلی رنگ پایینی وجود دارد.یک پلاتویی با مقدار بیشینه 0.4 واحد از ستون 1 تا 5 ( بالاترین غلظتهای انتی بادی گیرنده) وجود دارد که مشخص میکند انتی ژن به دام می افتد.چند دلیل برای مقدار OD پایین در این ناحیه وجود دارد.
- انتی بادی های گیرنده اختصاصی برای انتی ژن نسبت به دیگر پروتیین های سرم در یک غلظت پایین وجود دارند یا علاوه بر دیگر پروتیین ها متصل نمیشوند.بنابراین مقدار انتی ژن به دام افتاده محدود میشود.در این حالت هیچ افزایشی در OD در برابر افزایش غلظت انتی بادی گیرنده وجود ندارد.
- مقدار انتی ژن در دسترس برای به دام افتادن پایین است .این بعید است چون رقیق سازی انتی ژن (از A به B به C و به همین ترتیب) OD مشاهده شده را در ستونهای 1 تا 4 را کاهش نمیدهد که مشخص میکند یک مازاد انتی ژن تا ردیف F وجود دارد( بعد از آن کاهش در OD را مشاهده میکنیم).
- فعالیت کنژوگه پایین است
CBT را میتوان با استفاده از غلظتهای اغازین افزایش یافته اجزای تیتر شده تکرار کرد.بنابراین میتوانیم غلظت انتی بادی گیرنده را با 10 برابر آنچه که در اولین CBT استفاده شده شروع کنیم .این غیر ممکن است ، با این حال مقدارهای OD را افزایش میدهد چون مشاهده میکنیم که بیشینه پلاتو (ستون های 1 تا 5) وسیعی وجود دارد که مشخص کننده بیشینه فعالیت اندازه گیری شده است که در برابر رقیق شدن انتی ژن تغییر نمیکند.
در مواردی که افزایش OD در برابر افزایش انتی بادی گیرنده دیده میشود میتوان CBT را دوباره ارزیابی و مرحله (ii) از CBT را انجام داد.وقتی هیچ افزایشی در مقدارهای OD با غلظتهای افزایش یافته انتی ژن یا کنژوگه وجود ندارد قویترین گزینه برای جایگزینی، انتی بادی گیرنده است.وقتی این انتی بادی همان انتی بادی است که برای کنژوگه کردن استفاده شده پس باید هردو جایگزین شوند.
رنگ بیش از حد
وقتی رنگ خیلی زیادی در بیشتر چاهک ها وجود دارد CBT را باید با غلظتهای پایینی از واکنشگرها تکرار نمود .جدول 18 داده های چنین پلیتی را نشان میدهد.ریاجنتی که سبب خوانش بالا شده است ممکن است بطور مستقیم از CBT شناسایی شود .بررسی دقیق تر مقدارهای پس زمینه نیز لازم است چون نتایج ممکن است بخاطر اتصال بالای غیر اختصاصی یکی از واکنشگرها باشد.
داده های جدول 18 پس زمینه بالایی را برای کنژوگه در غیاب سرم گیرنده (ستون 12) نشان میدهد.ردیف H مشخص میکند در حالتی که انتی ژن و انتی بادی گیرنده وجود دارد و کنژوگه وجود ندارد هیچ رنگی بدست نیامده است.بنابراین رنگ غیر اختصاصی ناخواسته به علت چسبیدن کنژوگه انزیم به چاهک ها است.این نشان میدهد که کنژوگه در یک غلظت خیلی بالایی بکار رفته است ،بنابراین بافر مسدود کننده از جذب غیراختصاصی پروتیین های نشاندار شده با انزیم پیش گیری نمیکند.تیتراسیون انتی ژن دربرابر رقیق شدن سرم گیرنده وجود دارد که در پس زمینه ها در ستون 12 مشخص شده است برای مثال در ردیف G که پس زمینه 0.9 دارد یک پلاتو تقریبی 2.0 دیده میشود با یک OD بالای پس زمینه موجود در ستون 11 و کاهش رنگ تدریجی که از ستون های 3 و 4 تا ستون 11 دیده میشود.
CBT دیگری را میتوان با استفاده از کنژوگه در ردیف F که در بار اول بدست امد انجام داد .جدول 19 نتایج خوبی را نشان میدهد.در اینجا پس زمینه تا ردیف D حذف میشود( یعنی نتایج یکسانی در D12 ، E12 ،F12 ،G12 است).اثری که رقیق کردن انتی بادی گیرنده دارد تیتر کردن انتی ژن بعد از یک پلاتوی اولیه است (ناحیه مازاد انتی بادی گیرنده یا انتی ژن ).رقت کنژوگه تا ردیف D ، به دلیل پس زمینه بالا مناسب نیست .بنابراین رقت کنژوگه در حدود ردیف های D و E را میتوان در مرحله دوم CBT ، که درآن انتی بادی گیرنده و انتی ژن تغییر میکند دوباره ارزیابی کرد.
واکنش های خیلی ضعیف
در مواردی که رنگ خیلی ضعیفی مشاهده میشود، با مشکلات بیشتری روبه رو میشویم چون هیچ شاخص روشنی که یک یا تمام ریاجنتها عمل نمیکنند وجود ندارد.یک مورد ویژه هنگامی است که حتی پس از یک زمان قابل ملاحظه اینکوباسیون با سوبسترا / رنگزا تشکیل رنگی وجود ندارد.محتمل ترین علت، فراموش کردن ریختن سوبسترا به مخلوط واکنش توسط کاربر است.این علت را میتوان با فروبردن یک نوک سمپلر در کنژوگه و قرار دادن نوک در داخل محلول سوبسترا/ رنگزای باقی مانده ازمایش کرد.باید یک تغییر رنگ سریع دیده شود.اگر تغییر رنگ دیده نشد، کاربر باید ازمایش را تکرار نموده و اطمینان حاصل کند که مخلوط درستی از سوبسترا / رنگزا تهیه شده است.
وقتی رنگ وجود دارد CBT را میتوان تکرار کرد.اگر رنگ خیلی کمی بدست امد ، CBT اولیه باید با غلظتهای خیلی بالاتر، از دو ریاجنت تیتر شونده ، شروع شود.این کار می تواند بطور نسبی بی فایده باشد چون ما رقت های واکنشگرها را میدانیم و معمولا این ها را با غلظت بالا در CBT اولیه اضافه کرده ایم.روشن است که واکنشگر سوم ( کنژوگه ) می تواند مهم باشد پس در غلظت بالاتری می تواند اضافه شود.
دوباره در اینجا، اگر کنژوگه در رقتهای 1/100 و پایین تر واکنش ندهد استفاده از آنها ارزش عملی کمی دارد.
بنابراین رنگ پایین می تواند ناشی از یک خطا مانند اشتباه در اضافه کردن ریاجنتهای درست ، اشتباه کردن در رقت های اصلی یا بکار بردن واکنش گرهای با قدرت ناکافی باشد.
ارزیابی علت رنگ پایین هنگامی که میدانیم یکی از ریاجنتها فعال است اسانتر است .این موضوع در جدول 20 مثال زده شده است که در ناحیه ای از پلیت در ستون 1 و ردیف های AتاE مقداری رنگ تشکیل شده است.ازآنجایی که مقدار ثابتی از انتی ژن و 1.5 واحد OD در ستون 1 دیده می شود نشان میدهد که هم انتی ژن و هم کنژوگه دارای عملکرد هستند اگر چه فعایت کنژوگه به سرعت بعد از ردیف C کاهش می یابد.
ضعف در اینجا ناشی از انتی بادی گیرنده است ، که توانایی آن در به دام انداختن ، تا ستون 3 به سرعت کم می شود.CBT را میتوان با غلظتهای بالاتر در ستون 1 تکرار نمود.همانطور که مشخص شد از آنجایی که این انتی بادیهای گیرنده جز کوچکی در پروتیین های سرم هستند و فعالیت گیرندگی آنها وابسته به توانایشان در اتصال به چاهک ها است ممکن است رسیدن به یک ریاجنت بهتر از نظر گیرندگی با این سرم ممکن نباشد.
2.2.6
CBT برای دیگر سیستم ها
مثالهای اخیر به منظور مشخص کردن گام های طراحی اولیه در تحلیل مناسب بودن ریاجنتهای موجود بودند.در تمام موارد همیشه نیاز بوده است تعدیل هایی را صورت دهیم تا روشهای تعریف شده ازمایش بناگذاری شود.CBT تنها براوردی خام از فعالیت ها است.
سیستم های پیچیده تر ( مثلا آنهایی که وابسته به چهار واکنشگر هستند) وابسته به انتخاب پارامترهای نه چندان دقیق برای دو تا از ریاجنتها و بررسی اثر رقیق سازی دوتای دیگر است .در طراحی چنین سنجش هایی میتوان ازطراحی دیگر سیستم های الایزا با استفاده از همین ریاجنتها کمک گرفت.مثالهایی زده خواهد شد.
طراحی الایزای ساندویچ غیر مستقیم
ما پیشتر انتی بادی های گیرنده را در الایزای ساندویچ مستقیم تیتر کردیم .بنابراین غلظتهای موثر انتی بادیهای گیرنده ، انتی ژن و کنژوگه معلوم است . اکنون میخواهیم الایزای ساندویچ غیر مستقیم طراحی کنیم که انتی بادی های نشاندارشده علیه انتی ژن هدف با یک سرم تشخیص دهنده غیر نشاندار و یک کنژوگه ضد گونه جایگزین میشوند.یک دلیل خوب برای این کار استفاده از سرم های حیوانی مختلف برای ازمایش است .یک نقطه شروع خوب انجام CBT با استفاده از انتی بادی های گیرنده ثابت وانتی ژن ثابت و تیتراسیون سرم تشخیص دهنده و کنژوگه است .گونه های سرم تشخیص دهنده باید متفاوت از انتی بادی گیرنده باید باشد چون ما در حال استفاده از یک کنژوگه ضد گونه (کنژوگه ضد گونه نباید فعالیت الایزا علیه انتی بادی های کوت کننده داشته باشد)هستیم .شرایط مناسب شده کوتینگ و غلظتهای انتی ژن را میتوان در ابتدا استفاده کرد.اگر ازمایش موفقیت امیز بود میتوان تعدیل های لازم را با تغییر غلظتهای هر یک از واکنشگرها انجام داد.
تثبیت غلظت ریاجنتها در ازمایشاتی غیر از آنهایی که در نهایت استفاده شده اند غیر معمول نیست .درحقیقت از پیش تیتراسیون در دیگر سیستمها به عنوان یک ابزار هدفمند استفاده میشود.در بسیاری از موارد ازمایشگاهها درحال کار با طیف محدودی از انتی ژنها وانتی بادی ها هستند و بهره برداری از اینها در سیستم های دیگر ناشی از نیاز به بهبود متدهای تعریف شده با یک کار خاص در دسترس است.اتصال ریاجنت به طراحی منوکلونال انتی بادی ها (mabs) توسعه پیدا میکند طوری که در بعضی مرحله ها ممکن است از انتی بادی های پلی کلونال برای تولید ازمایشی اختصاصی تر یا حساستر استفاده شود.به عنوان مثال یک الایزای ساندویچ غیر مستقیم بر پایه سرم پلی کلونا ل موجود است و ما درحال بررسی یک انتی بادی تشخیص دهنده منوکلونال هستیم ( احتمالا برای اینکه ببینیم ایا میتوانیم اختصاصیت تشخیص انتی ژن به دام افتاده را افزایش دهیم).در اینجا CBT اولیه شامل انتی بادی گیرنده و انتی ژن با غلظت ثابت است و انتی بادی منوکلونال و کنژوگه ضد موش تیتر میشوند.حتما باید اطمینان داشت که ( بنا بر الایزای اصلی مبتنی بر پلی کلونال )هدف های انتی ژنی به دام افتاده کافی برای منوکلونال انتی بادی ها فراهم میشود.بطوری مشابه فعالیت انتی بادی های منوکلونال به عنوان ریاجنت به دام اندازنده می تواند با استفاده از اجزای ثابت شامل انتی ژن ،سرم تشخیص دهنده پلی کلونال ، و کنژوگه ارزیابی شود.


























خواهش میکنم خوشحالم که مطالب مفید واقع شده اند.