کروماتوگرافی (chromatography)-بخش اول
کروماتوگرافی و استخراج (chromatography and extraction)
مایع های زیستی مخلوط های پیچیده ای هستند و آزمایشهای بالینی برای اجزای خاصی از این مایع ها اغلب یک یا چند مرحله جداسازی پی در پی را می خواهد تا اجزای مورد نظر جدا یا تغلیظ شوند.روشهای معمول برای دست یافتن برای این جداسازی شامل 1) کروماتوگرافی (chromatography) 2) استخراج (extraction) 3) پرسیپیتاسیون افتراقی (differential precipitation) 4) الکتروفورز (electrophoresis) .این فصل مفاهیم پایه و اصول کروماتوگرافی و استخراج را که به عنوان تکنیکهای آنالیتیکال بکار میروند را توصیف میکند.
کروماتوگرافی (chromatography)
کروماتوگرافی فرایندی است که در آن اجزای یک مخلوط به وسیله توزیع افتراقی (differential distribution) میان فاز متحرک (mobile phase) و فاز ثابت (stationary phase)، جدا میشوند.اجزای با توزیع بیشتر به درون فاز ثابت ، بیشتر نگه داشته میشوند (retained) و بسیار به آهستگی درون سیستم حرکت میکنند.توصیف ابتدایی این تکنیک به وسیله Mikhail Tswett در سال 1903 انه انجام شد و شامل جداسازی رنگدانه های گیاهی به شکل باند های رنگی جداگانه در یک ستون کربنات کلسیم بود.او واژه کروماتوگرافی را برای اولین بار بکار برد که از کروما (chroma) و گرافین (graphein) ( واژه یونانی برای رنگ و نوشتن ) و این واژه ادامه پیدا کرد حتی برای بیشتر جداسازی هایی که دارای اجزای رنگی نبودند.
دو شکل پایه ای کروماتوگرافی ، صفحه (planar) ای و ستونی (column) هستند (شکل 13-1) .
در کروماتوگرافی صفحه ای (planar chromatography) ، فاز ثابت روی یک برگ کاغذ ( کروماتوگرافی کاغذی =paper chromatography) پوشانده میشود و یا به یک سطح جامد (کروماتوگرافی لایه نازک (TLC)==thin-layer chromatography) متصل میشود.در کروماتوگرافی کاغذی فاز ثابت یک لایه آب یا یک حلال قطبی (polar solvent) است که بر روی فیبرهای کاغذ پوشانده میشود. در کرواتوگرافی لایه نازک (TLC) یک لایه نازک از ذرات (particles) از یک ماده مانند سیلیکا ژل (silica gel) به طور یکنواخت روی یک صفحه شیشه ای یا یک ورق پلاستیک یا آلومینیوم پخش میشود.هنگامی که لایه نازک از ذرات با قطر بسیار کوچک به اندازه 4.5 um ساخته شده باشد ، این تکنیک را کروماتوگرافی لایه نازک با کارایی بالا (high-performance thin-layer chromatography=HPTLC) مینامند.
در کروماتوگرافی ستونی ، فاز ثابت ممکن است سیلیکای خالص یا یک پلیمر باشد، و ممکن است بر روی ذرات پایه (support particles) پوشانده شوند و یا به صورت شیمیایی به آن متصل شوند.فاز ثابت ممکن است درون یک لوله ، فشرده (packed) شود و یا ممکن است بر روی سطح درونی لوله پوشانده (coated) شود.کروماتوگرافی ستونی شامل کروماتوگرافی گازی (gas chromatography=GC) و کروماتوگرافی مایع (liquid chromatography=LC) است با این طبقه بندی که فاز ثابت یک گاز باشد یا یک مایع . از نظر عملکردی به دستگاهی که جداسازی GC یا LC را انجام میدهد gas chromatograph یا liquid chromatograph میگویند.هنگامی که فاز ثابت در کروماتوگرافی مایع دارای ذرات با قطر بسیار کوچک باشد ، تکنیک را کروماتوگرافی مایع با کارایی بالا (high-performance liquid chromatography=HPLC) مینامند.هنگامی که یک کروماتوگراف گازی به یک اسپکترومتر جرمی (mass spectrometer) متصل شود، تکنیک ترکیبی را گاز کروماتوگرافی – اسپکترومتری جرمی (GC-MS) و اگر یک کروماتوگراف مایع به اسپکترومتر جرمی متصل شود تکنیک ترکیبی را کروماتوگرافی مایع – اسپکترومتری جرمی (LC-MS) مینامند.
در کروماتوگرافی گازی یا کروماتوگرافی مایع ، فاز متحرک یا ایلوانت (eluent) از ستون خارج شده و از یک آشکارساز میگذرد و تولید سیگنال میکند که این سیگنالها به عنوان تابعی از 1) زمان (time) 2) فاصله (distance) 3) حجم (volume) رسم میشوند.نمای گرافیکی بدست آمده را کروماتوگرام (chromatogram) می نامند (شکل 13-2).
زمان نگه داشت (retention time) یا حجم، فاصله زمانی یا حجم لازم است برای اینکه یک ماده حل شونده (solute) از تزریق کننده و از طریق ستون به سوی آشکارساز بگذرد.داده های نشان داده شده به وسیله کروماتوگرام برای شناسایی (identify) و تعیین مقدار (quantify) ماده یا مواد حل شونده بکار برده میشود.از آنجایی که مواد حل شونده خارج شده (eluting solutes) به شکل یک سری قله (peak) نمایش داده میشوند بنابراین به آنها پیک های کروماتوگرافی (chromatographic peaks) میگویند.
این پیک ها را به صورتهای 1) پهنا (width) 2) بلندا (height) و 3) سطح (area) پیک توصیف میکنند.درکروماتوگرافی صفحه ای ناحیه های جداشده به وسیله رنگهای طبیعی خودشان و یا به کمک اصلاح با مواد شیمیایی (chemical modification) ، نقطه ها یا باندهای رنگی ایجاد و قابل دیدن میشوند. از این نقطه ها یا باندها در شناسایی کیفی یا تعیین مقدار آنالیت های مختلف استفاده میشود.
مکانیسم های جداسازی (separation mechanisms)
جداسازی کروماتوگرافی به وسیله مکانیسم های شیمیایی و فیزیکی در جداسازی مواد حل شونده ،طبقه بندی میشود.(شکل 13-3).
این مکانیسم ها شامل 1) تعویض یون (ion-exchange) 2)جذب سطحی (adsorption) 3) توزیع (partition) 4) اندازه (size-exclusion) می باشند.بیشتر کاربردهای بالینی از جداسازی کروماتوگرافی بر پایه تعویض یون و توزیع بهره میگیرند.
تعویض یون (ion-exchange)
کروماتوگرافی تعویض یون بر پایه تعویض یون میان گروه های باردار متصل به فاز ثابت و یونهای دارای بار مخالف در فاز متحرک است(شکل 13-3را ببینید). بسته به بار فاز ثابت اجزای متصل شونده به ستون ممکن است کاتیون ها (دارای بار مثبت) یا آنیون ها (دارای بار منفی) باشند.فازهای جامد تعویض کاتیون (cation-exchange solid phases) دارای گروه های عملکردی دارای بار منفی هستند که بصورت کووالانسی متصل شده اند.نمونه های آن شامل گروه های اسیدی قوی مانند یونهای سولفونات (sulfonate iones) یا گروه های اسید ضعیف مانند کربوکسیل (carboxyl) یا کربوکسی متیل(carboxymethyl) میباشد. فازهای جامد تعویض آنیون (anion-exchange solid phases) دارای آمین های چهار ظرفیتی بازی بسیار قوی (strongly basic quaternary amines) مانند گروه های تری اتیل آمینو اتیل(triethylaminoethyl) یا گروه های بازی ضعیف مانند امینو اتیل (aminoethyl) و دی اتیل امینو اتیل (diethylaminoethyl)می باشد.جداسازی با این شرایط انجام میشود که آنالیت ها باردار هستند و به فاز ثابت تعویض-یون متصل میشوند.مواد حل شونده با محلول دارای یونهای مخالف رقابت کننده(competing counteriones) خارج میشوند (eluted) ، یونهای مخالف مانند سدیم برای تعویض کاتیون و کلراید برای تعویض آنیون و در شماری از موارد با تنظیم pH برای کم کردن بار یونهای متصل یا بار سطح تعویض-یون .عامل های مهم در کارایی کروماتوگرافی تعویض-یون شامل 1) نوع گروه یونی فاز ثابت 2) چگالی بار 3) ماتریکس فاز ثابت 4) نوع و غلظت یونها در فاز متحرک 5) pH فاز متحرک .بسیاری از فازهای ثابت یک حالت مخلوط از نگه داشت (retention) را به وسیله ترکیبی از تعویض یون و اتصال جذب سطحی (adsorptive binding) را نشان میدهند.برای نمونه ،رزین های تعویض-یون که برای انالیز امینو اسیدها بکار میروند ، توانایی جداسازی امینو اسیدها را با بار یکسان دارند و این بخاطر برهم کنش جذبی متغیر (variable adsorptive interactions) امینو اسیدهای مختلف با فاز ثابت است.شماری از محیط های استخراجی فاز-جامد طوری طراحی شده اند که یک نگه داشت مخلوط از هیدروفوب – تعویض یون را دارا هستند و یک توانایی انتخابی بالایی (improved selectivity) را در برابر محیطهای استخراجی که بیشتر برای استخراج هیدروفوب و یا استخراج تعویض یون طراحی شده اند از خود نشان میدهند.
کروماتوگرافی تعویض یون شماری کاربردهای بالینی دارد شامل انالیز امینو اسیدها و هموگلوبین ها. همچنین در انالیز یونهای غیر آلی (inorganic iones) و آلی (organic iones) کوچک به کمک آشکارسازی هدایت سنجی (conductivity detection) ، با تکنیکی به نام کروماتوگرافی یون (ion chromatography) بکار گرفته میشود. تخلیص آب (water purification) یک کاربرد فراوری مهم از کروماتوگرافی تعویض یون است که در آن از رزین های بستر مخلوط (mixed-bed resins) که مبادله گرهای کاتیون و انیون را باهم دارا هستند استفاده میشود.با تعویض یونهای هیدروژن با دیگر کاتیون ها و یونهای هیدروکسیل با دیگر آنیون ها ، همه یونها حذف میشوند.یونهای هیدروژن و یونهای هیدروکسیل که با یونهای نمک (salt iones) جابجا شده اند آب را تشکیل میدهند.
جذب سطحی (adsorption)
پایه جداسازی به وسیله کروماتوگرافی جذب سطحی (adsorption chromatography) اختلاف میان جذب سطحی (adsorption) و دفع سطحی (desorption) مواد حل شونده در سطح ذره جامد است (شکل 13-3 را ببینید) .الکترواستاتیک ، پیوند هیدروژنی و برهم کنش وان در والس (van der waals) نیروهای فیزیکی هستند که این نوع از کروماتوگرافی را کنترل میکنند.همانطور که مولکولهای حلال برای اتصال به فاز ثابت رقابت میکنند ، قدرت اتصال به فاز ثابت بستگی به ویژگی های فاز ثابت و ویژگی های فاز متحرک دارد.بطور کلی برای یک فاز ثابت قطبی (polar stationary phase) خروج (elution) بر پایه قطبیت (polarity) اجزای مخلوط است : اجزای کمتر قطبی اول خارج میشوند و به دنبال آنها اجزایی که قطبیت بیشتری دارند.
در کروماتوگرافی گازی ، از این حالت برای جداسازی ترکیبات با وزن مولکولی پایین مانند متیل ، اتیل ، و ایزوپروپیل الکل ها از ترکیباتی که به طور طبیعی در دمای اتاق به حالت گاز هستند استفاده میشود.در این نوع از کروماتوگرافی گازی از ذرات پایه ای مانند غربالهای مولکولی الومینا (alumina) و کو پلیمرهای استایرین – دی وینیل بنزین استفاده میشود. در کروماتوگرافی مایع سه نوع از جاذب (adsorbents) ها به طور کلی بکار گرفته میشوند 1) غیر قطبی (nonpolar) 2) قطبی اسیدی (acid polar) 3) قطبی بازی (basic polar) .جاذب های غیرقطبی (nonpolar adsorbents) شامل ذغال و پلی استایرین – دی وینیل بنزین است.اصلی ترین جاذب قطبی اسیدی ، ژل سیلیکا است که گروه های سیلانول (SiOH) سطحی مواد بازی را جذب میکنند.الومینا (alumina) اصلی ترین جاذب بازی است که مواد اسیدی را نگه میدارند.فلوریسیل (florisil) هم به عنوان یک جاذب بازی در هنگامی بکار رفته است که تجزیه کاتالیتیکی( catalytic decomposition) انالیت به وسیله الومینا رخ میدهد.
کروماتوگرافی مایع با برهم کنش هیدروفیل (hydrophilic interaction liquid chromatography = HILIC) یک نوع کروماتوگرافی جذب سطحی است که برای جداسازی ترکیبات بسیار قطبی بکار میرود، این ترکیبات بسیار قطبی با فاز ثابت دارای سطح نسبتا قطبی ، پیوندهای هیدروژنی تشکیل میدهند.نمونه های فاز ثابت که برای HILIC بکار میرود شامل 1) سیلیکای اصلاح نشده (unmodified silica) 2) سیلیکا با گروه های زوویتریونی متصل شده 3) ترکیبات پر از گروه هیدروکسیل (hydroxyl-rich compounds) 4) ترکیبات پر از امید (amide-rich compounds) .اتصال ابتدایی مواد حل شونده به فاز ثابت در حلال های بطور نسبی هیدروفوب انجام میشود و خارج شدن (elution) آنها با حلالهایی که قطبیت آنها رو به افزایش است به دست می آید.یکی از محدودیت های HILIC در کاربری آزمایشگاه های بالینی این است که مایع های زیستی بسیار قطبی هستند و شامل مقدار قابل توجهی از نمک ها هستند که میتوانند با فاز ثابت قطبی بر هم کنش دهند.بنابراین لازم است نمونه ها استخراج شده یا با افزودن یک حلال کمتر قطبی مانند استونیتریل (acetonitrile) آنها را تشویق به اتصال به فاز ثابت نمود.علاقه رو به رشدی در کاربرد HILIC به عنوان یک تکنیک جداسازی متصل به اسپکترومتری جرمی وجود دارد اما بیشتر جداسازی ها در آزمایشگاه های بالینی بر پایه جداسازی در فاز معکوس (reversed-phase) یا تعویض-یون است .
کروماتوگرافی توزیع (partition chromatography)
توزیع متفاوت مواد حل شونده میان دو مایع مخلوط ناشونده پایه جداسازی در کروماتوگرافی توزیع است (شکل 13-3 را ببینید).در عمل یکی از مایع های مخلوط ناشونده به عنوان فاز ثابت عمل میکند.برای فراهم کردن چنین فازی یک لایه نازک از مایع بر روی سطح ذرات پایه (support particles) یا دیوار درونی یک ستون مویین ،جذب سطحی شده (adsorbed) و یا بصورت شیمیایی به آن متصل میشود.
در کروماتوگرافی توزیع فاز-معکوس (reversed-phase partition chromatography) 1) فاز ثابت غیر قطبی است 2) فاز متحرک نسبتا قطبی است 3) مولکولهای هیدروفوب ،بطور ترجیحی نگه داشته میشوند.این نوع از کروماتوگرافی پرکاربردترین تکنیک در استخراج فاز-جامد و کروماتوگرافی مایع در آزمایشگاه های بالینی است.یک نمونه از جداسازی چند داروی ضد افسردگی به وسیله کروماتوگرافی فاز-معکوس در شکل 13-2 نشان داده شده است.نمونه هایی از فازهای ثابت برای جذب سطحی فاز-معکوس (reversed-phase adsorption) شامل سیلیکا با گروه های هیدروفوب متصل شده است ، گروه های هیدروفوب مانند اکتا دسیل (C18) ، اکتیل (C8) ، فنیل یا بوتیل (C4) و پلی استایرین – دی وینیل بنزین است.در استخراج های فاز-جامد ،مواد همسانی بکار میرود شامل کوپلیمر های استایرین (styrene) با منومرهای بیشتر هیدروفیل که فاز های ثابتی با ویژگی هیدروفوب-هیدروفیل تعادل یافته را از خود نشان میدهند و یا همراه با گروه های باردار (charged groups) میشوند که یک استخراج حالت مخلوط (mixed mode extraction) را با ویژگی نگه داشت هیدروفوب و تعویض-یون از خود نشان میدهند.ویژگی های نگه داشت فازهای ثابت بر پایه سیلیکا بستگی دارد به 1) ماهیت فازهای متصل شده 2) مقدار فاز متصل شده (بیشتر بصورت درصد بار کربن = %carbon load گفته میشود) 3) سطح ذرات 4) اندازه روزنه ذرات 5) مقدار گروه های سیلانول در دسترس روی ذرات سیلیکا که بستگی دارد به تیمارگری سطح (surface treatment) به نام پایانه پوشانی (end-capping) که در آن گروه های سیلانول با گروه های تری متیل سیلیل (trimethysilyl) جایگزین میشوند.در جداسازی های فاز-معکوس محلول ها در یک حلال قطبی مانند آب و یا نسبتا قطبی مانند آب همراه با یک غلظت کمی از یک حلال آلی مانند متانول یا استونیتریل بکار میروند.جداسازی های فاز-معکوس بیشتر همراه با نمونه های آبی (aqueous specimens) مانند خون و ادرار بکار میروند چون بیشتر حلال (آب) و نمک های غیر آلی از میان ستون با کمترین نگه داشت میگذرند.
توزیع مواد حل شونده در جداسازی های فاز-معکوس بطور معمول با تنظیم pH طوری که بار مواد حل شونده کاهش یابد به نفع یک یا چند ماده حل شونده تغییر می یابد برای نمونه کاهش pH که سبب میشود اسیدهای آلی به شکل غیر باردار در آیند، نیز با افزودن عامل های جفت شونده یونی (ion-pairing agents) که جفت های یونی کمتر قطبی ایجاد میکنند میتوان جداسازی را به نفع یک یا چند ماده حل شونده تغییر داد.
استفاده از فازهای هیدروفوب-هیدروفیل تعادل یافته (balanced hydrophobic-hydrophilic phases) در جداسازی ها نیاز به خیساندن (wetting) فاز ثابت را برطرف میکند و همچنین از مشکلات فروریختن فاز (phase collapse) در بارگذاری محلولهای آبی پیش گیری میکند.فازهای ثابت پلیمری معمولا ظرفیت بالاتری نسبت به فازهای ثابت سیلیکای متصل (bonded silica stationary phases) دارد به این خاطر که همه ذرات به عنوان فاز ثابت عمل میکنند.
خروج ترکیبات در جداسازی های فاز-معکوس بر پایه رقابت مولکولها در فاز متحرک با مولکولهای متصل شده به فاز ثابت استوار است.خروج (elution) با تغییر قدرت حلال بصورت خطی یا بصورت شیب گام به گام و یا با تغییر pH برای افزایش دادن قطبیت مواد حل شونده ، شتاب داده میشود.قدرت حلال ها، گاهی به سری ایلوتروپیک (eluotropic series) از آنها یاد میشود و برای جداسازی های فاز-معکوس بطور کلی از ترتیب زیر پیروی میکند.
Pentane > Cyclohexane > Toluene > Dichloromethane > Ethylacetate > Acetonitrile > Ethanol > Methanol > Water
حلالهای بیشتر هیدروفوب بطور کلی ایلوانت های قوی تری در جداسازی های فاز-معکوس هستند.در کروماتوگرافی فاز-نرمال (فاز ثابت قطبی ، فاز متحرک غیرقطبی)، سری ایلوتروپیک بر عکس است.در عمل این امکان وجود دارد که قدرت حلال را با بکار گیری مخلوطی از حلال ها و شیب هایی از نسبت های متغیر حلال ها هنگام انالیز ، تغییر داد( شکل 13-4).
همچنین این امکان وجود دارد که قطبیت محلول های آبی را با تغییر غلظت نمک اصلاح نمود.از این ویژگی در یک نوع کروماتوگرافی فاز-معکوس به نام کروماتوگرافی برهم کنش هیدروفوبی (hydrophobic interaction chromatography) و بطور عمده در جداسازی پروتیین ها استفاده شده است.
اتصال به فاز ثابت هیدروفوبی ضعیف که دارای گروه های برهم کنش دهنده مانند فنیل (phenyl) یا بوتیل (butyl) است با بارگذاری نمونه ها در یک محلول با غلظت نمک بالا تشویق میشود و خروج (elution) آنها با پایین آوردن غلظت نمک بجای افزودن یک حلال آلی حاصل میشود.
یک بازه گسترده ای از فازهای جامد برای جداسازی فاز-معکوس وجود دارد که ویژگی های متفاوت کمی از هم دارند و شماری از آنها جداسازی را در حالت مخلوط (mixed mode) انجام میدهند.شماری از فازهای جامد مانند گرافیت روزنه دار (porous graphite) یا هیدروکربنهای فلوئورینه (fluorinated hydrocarbons) یا فازهای ثابت هیدروفوبی با گروه های قطبی درج شده در آنها انتخاب های متفاوتی (different selectivities) از C18-silica معمول میدهند.فازهای ثابت متصل شده به سیلیکا ویژگی تعویض-کاتیون ضعیف و یک ویژگی فاز-نرمال را داراست بسته به مقدار گروه های هیدروکسیل در دسترس روی سیلیکا.ترکیبات بازی ممکن است قله دنباله دار (peak tailing) را از خود نشان دهند که در تعویض-یون با سیلیکا ایجاد میشود.ویژگی های تعویض یون در سیلیکا با اصلاح شیمیایی سطح آن برای بستن گروه های هیدروکسیل و با انجام کروماتوگرافی در pH پایین ، کاهش می یابد.سیلیکا در pH بیشتر از 7 به آهستگی شروع به حل شدن میکند بنابراین ذرات سیلیکا معمولا نیازمند جداسازی در pH زیر 8 هستند مگر اینکه سیلیکا با تیمارگری سطح آن،پایدار شده باشد.دیگر انواع فازهای ثابت مانند پلی استایرین یا گرافیت روزنه دار در pH های بالا پایدار هستند و جداسازی در بازه گسترده ای از pH با آنها مقدور است.
به دلیل تنوع گسترده فازهای ثابت با قدرتهای انتخابی متفاوت و توانایی گسترده در تغییر دادن شرایط حلال ها و عامل های جفت شونده یونی،کروماتوگرافی فاز-معکوس یک تکنیک پرکاربرد است و بیشتر جداسازی ها با آن با کارایی بالا و قله های نوک تیز حاصل میشود.ترکیباتی که بزرگترین چالش را در جداسازی فاز-معکوس نشان میدهند یونهای کوچک و ترکیبات بسیار قطبی مانند قندها یا امینواسیدها هستند که در محیطهای فاز-معکوس و ترکیبات بازی بسیار ضعیف نگه داشته میشوند (weakly retained) و در اثر برهم کنش با سیلیکا قله دنباله دار را نشان میدهند.مشتق سازی (derivatization) ترکیباتی مانند امینو اسیدها برای بهبود نگه داشت فاز-معکوس آنها انجام شده و کروموفور و فلوروفورهایی به آنها برای بهبود آشکارسازی افزوده شده است.جداسازی پپتیدهای بزرگ یا پروتیین ها نیازمند فازهای ثابت با اندازه روزنه بزرگتر از آنچه که بطور معمول برای جداسازی مولکولهای کوچک بکار برده میشود، میباشد.
جداسازی کایرال (chiral separations)
بسیاری از مولکولهای زیستی به شکل استرئوایزومری خاصی وجود دارند مانند ال-امینواسیدها (L-aminoacids) و در شماری از موارد تنها یک استرئوایزومر ویژه از یک داروی درمانی فعال میباشد.بطور کلی شکلهای تصویر-آینه ای یک ترکیب یا همان انانتیومرها (enantiomers) ویژگی های بسیار همانند فیزیکی داشته و در بیشتر انالیزهای کروماتوگرافی جدا نمی شوند.جداسازی انانتیومرها بطور کلی نیازمند یک فاز ثابت است که یک جز انانتیومری داشته و به شیوه خاص استرئوایزومری با مولکولها برهم کنش میدهد.برای نمونه فازهای ثابت کایرال که دارای گروه هایی مانند ال-امینواسیدهای مشتق شده (derivatized L-aminoacids) یا کربوهیدراتهای استرئواسپسیفیک (stereospecific carbohydrates) هستند برای جداسازی انانتیومرها بکار رفته اند.
کروماتوگرافی اندازه (size exclusion chromatography)
کروماتوگرافی اندازه که آن را 1) gel filtration 2) gel permeation 3) steric exclusion 4) molecular exclusion 5) molecular sieve chromatography نیز مینامند، تکنیکی است که مولکولها یا دیگر ذرات را بر پایه اندازه جدا میکند( شکل 13-5).
در این تکنیک ،فاز ثابت از ذرات روزنه دار با سطح خنثی و طوری طراحی شده است که کمترین جذب سطحی اجزای نمونه را داشته باشد.موادی که در فاز ثابت بکار برده میشوند شامل دکستران با اتصال های متقاطع (cross-linked dextran)، پلی اکریلامید (polyacrylamide)، اگاروز، پلی استایرین (polystyrene)، و شیشه روزنه دار با پوشش سطحی خنثی میباشد.
بسترهایی از این مواد روزنه هایی را تشکیل میدهند و اندازه روزنه ها به مولکولهای کوچک اجازه وارد شدن را میدهد.مولکولهایی که بسیار بزرگ هستند و نمی توانند وارد روزنه ها شوند در فاز متحرک باقی مانده و همراه آن به سرعت از ستون خارج میشوند.مولکولهایی که از نظر اندازه میانه هستند به بخش هایی از روزنه ها دارای حجم متناسب دسترسی داشته و بین مولکولهای بزرگ و مولکولهای کوچک بر طبق رابطه زیر خارج میشوند.
که در آن Vr حجم نگه داشت (retention volume)، V0 حجم خالی میان ذرات ، K بخشی از حجم روزنه های در دسترس مولکولها و Vi حجم درون ذرات پایه است.
با کالیبرکردن ستون کروماتوگرافی اندازه با مولکولهایی با اندازه معلوم ، براورد اندازه مولکولی پروتیین ها و دیگر مولکولها امکان پذیر است.با این حال این یک تکنیک با توانایی جداسازی پایین به شمار میرود و نیازمند تفاوتهای نسبتی اساسی در وزن مولکولی (برای جداسازی) است.قطر پروتیین های کروی تنها در تناسب با ریشه سوم وزن مولکولی تغییر میکند،بنابراین یک تغییر هشت برابری در وزن مولکولی یک تغییر دو برابری در قطر ایجاد میکند.پلیمرهای خطی مانند DNA و پروتیین های دناتوره شده با سدیم دو دسیل سولفات یا گوانیدین هیدروکلراید قطر های بزرگتری برای همان وزن مولکولی دارند و قطر تقریبا در تناسب با ریشه دوم وزن مولکولی تغییر میکند و این مولکولهای خطی نسبت به مولکولهای کروی بهتر جدا میشوند.بنابراین آنالیز مولکولها در شرایط دناتوره کننده میتواند مشکل جداسازی مولکولها با اختلافهای کوچک در وزن مولکولی را حل کند.
کروماتوگرافی اندازه جداسازی مولکولها را در شرایط نمکی فیزیولوژیک فراهم میکند،این توانایی برای شناسایی کمپکسهای دست نخورده (intact) مولکولها مانند لیپوپروتیین ها ،کمپلکس های آنتی ژن-آنتی بادی و دیگر پروتیین های متصل شونده و لیگاندهای آنها در شرایط غیردناتوره کننده ملایم مفید است.همچنین این تکنیک بعنوان یک تکنیک فراهم کننده (preparative technique) سریع برای تعویض نمک (salt exchange) یا برای برداشت مولکولهای کوچک از مولکولهای بزرگ با استفاده از سانتریفوژ کوچک یا ستونهای گرانروی (gravity flow columns (کاربردی است.
دیگر جداسازی ها بر پایه اندازه
جداسازی بر پایه اندازه با غشاهای اولترافیلتراسیون یا ذرات با اندازه روزنه مشخص نیز انجام میشود.اولترافیلتراسیون در آزمایشگاه بالینی به عنوان یک تکنیک فراهم کننده برای جداسازی مولکولهای کوچک مانند امینو اسیدها و داروها از پروتیین ها است که در تکنیک های جداسازی قبلی از هم جدا نشده اند.اولترافیلتراسیون و دیالیز تعادلی (equilibrium dialysis) به عنوان وسیله هایی برای جداسازی اجزای آزاد از اجزای متصل به پروتیین مانند فنی تویین و تایروکسین آزاد بکار میرود.اولترافیلتراسیون همچنین به عنوان تکنیکی برای تغلیظ پروتیین ها در محلولهای رقیق مانند ادرار،برای انالیز در الکتروفورز یا دیگر تکنیک ها استفاده میشود. اولترافیلتراسیون بطور کلی برای جداسازی مولکولها یا ذرات که اختلاف بزرگی در اندازه دارند به عنوان نمونه بیشتر از 10 برابر اختلاف در وزن مولکولی ،کاربردی است.
کروماتوگرافی میل ترکیبی (affinity chromatography)
برهم کنش های مولکولی اختصاصی به عنوان پایه در کروماتوگرافی میل ترکیبی استفاده میشود(شکل 13-6).
نمونه های آن شامل 1) برهم کنش های آنتی بادی با آنتی ژن 2) آنزیم با سوبسترا 3) اپتامر (aptamer) با لیگاند 4) گیرنده (receptor) با لیگاند 5) و لکتین (lectin) با قند میباشد.فاز ثابت در کروماتوگرافی میل ترکیبی با نامتحرک کردن یک جز از یک جفت برهم کنش دهنده و استفاده از آن برای به دام انداختن (capture) جز دیگر، فراهم میشود.جهت گیری (orientation) مولکول به دام اندازنده و در دسترس بودن (accessability) ،عنصرهای مهم عملکردی مولکول به دام اندازنده هستند.با بکارگیری یک فاصله دهنده (spacer) برای ایجاد فاصله از سطح فاز ثابت ،در دسترس بودن و عملکرد مولکول به دام اندازنده بهبود پیدا میکند.یک شیوه جایگزین در طراحی ماتریکس های میل ترکیبی بدون لیگاندهای نامتحرک شده تشکیل سطح های چاپ شده مولکولی بر روی فاز به دام اندازنده است.شکل و ساختار روزنه های شکل گرفته به وسیله چاپ مولکولی ،اتصال انتخابی مولکولها را که ساختار مکمل دارند فراهم میکند.
برای انجام کروماتوگرافی میل ترکیبی یک محلول با شرایطی که اجازه اتصال اختصاصی به مولکول به دام اندازنده را فراهم میکند بکار برده میشود و اجزای متصل نشده به وسیله شستشوی فاز ثابت برداشته میشوند.اجزای متصل شده بطور اختصاصی، به وسیله افزودن لیگاند یا تغییر شرایط مانند pH یا قدرت یونی به منظور قطع اتصال به فاز ثابت، خارج میشوند.خروج کروماتوگرافیک حلال شوینده اغلب حین تغییر گام به گام حلال به منظور بررسی خروج اجزای مورد نظر به شکل یک بخش جداگانه، به دقت بازبینی میشود.
توانایی کروماتوگرافی میل ترکیبی به قدرت انتخاب گری (selectivity) آن بستگی دارد.کروماتوگرافی میل ترکیبی به طور گسترده ای برای خالص سازی آنتی بادی ها و دیگر پروتیین ها در سنجش های بالینی بکار رفته است.کروماتوگرافی میل ترکیبی به لکتین (lectin affinity chromatography) وسیله ای است برای بررسی تغییر ساختارهای الیگوساکاریدهای متصل به گلایکوپروتیین ها.فنیل بورونیک اسید (phenylboronic acid) نامتحرک شده در جداسازی هموگلوبین گلایکوزیله شده (glycated hemoglobin) از هموگلوبین اصلاح نشده (unmodified hemoglobin) استفاده شده است.بیشتر سنجش های ناهمگون (heterogenous assayes) در آزمایشگاه های بالینی بر پایه استخراج یا به دام انداختن یک مولکول هدف خاص بر روی یک فاز جامد و به همراه خارح کردن دیگر مولکولها میباشد.immunodepletion یا immunopartitioning نمونه های پر از پروتیین به عنوان وسیله ای برای فراهم کردن نمونه های زیستی در انالیز پروتئومی بکار رفته است به این وسیله تشخیص اجزا با فراوانی کم بهتر انجام شود.
توانایی جداسازی (resolution)
توانایی جداسازی (Rs) به میزان جداسازی دو جز گفته میشود (شکل 13-7).
بهترین توانایی جداسازی ، از قله های نوک تیز (sharper peaks) ( = کارایی بالای کروماتوگرافی =higher chromatographic efficiency) یا از جداسازی با فاصله بیشتر میان قله ها (= توانایی انتخاب بالا =higher selectivity) به دست میاید همانطور که در شکل 13-8 نمایش داده شده است.
توانایی جداسازی به زبان ریاضی به شکل زیر بیان میشود.
که در آن
r(A) t= زمان نگه داشت ماده حل شونده A
r(B) t= زمان نگه داشت ماده حل شونده B
W(A) = پهنای قله (یکای زمان ) اندازه گیری شده در پایه برای ماده حل شونده A
W(B) = پهنای قله (یکای زمان) اندازه گیری شده در پایه برای ماده حل شونده B
نگه داشت (retention) ممکن است به شکل یکای زمان (معادله پیشین) و یا حجم بیان شود (شکل 13-7 را ببینید).
یک توانایی جداسازی با مقدار 1.25 یا بزرگتر از آن نشاندهنده جداسازی خط پایه (baseline) قله ها است، توانایی جداسازی پایین تر نشاندهنده افزایش همپوشانی میان قله ها است همانطور که در شکل 13-9 نشان داده شده است. توانایی جداسازی با افزایش کارایی (efficiency) ( به دست آوردن قله های باریک تر) یا با بهبود انتخابگری (improving selectivity) میتواند سبب افزایش میان دو جز شود.دو روش برای افزایش توانایی جداسازی بکار بردن ستونهای بلندتر و انتخاب یک ستون با کارامدی بالاتر است.هر کدام از این گزینه ها که انتخاب شود N ، شمار پلیتهای تئوریک را افزایش میدهد.توانایی جداسازی متناسب با مربع ریشه N افزایش می یابد بنابراین دو برابر کردن طول ستون (دو برابر کردن N) سبب افزایش توانایی جداسازی با یک ضریب 1.41 خواهد شد.
فاکتور نگه داشت (retention factor)
فاکتور نگه داشت k’ سنجشی است از مدت زمان باقی ماندن یک ماده حل شونده در فاز ثابت نسبت به مدت زمان باقی ماندن آن در فاز متحرک.از نظر ریاضی عبارت است از نسبت حجم نگه داشت تعدیل شده (Vr) یا زمان نگه داشت (Tr) به حجم خالی یا اشغال نشده (V0) یا زمان سپری شده برای اجزای نگه داشته نشده در خروج از ستون (t0).
یک k’ با اندازه 0 نشاندهنده این است که هیچ اتصالی میان ماده حل شونده و فاز ثابت برقرار نمیشود.توزیع بیشتر به داخل فاز ثابت سبب میشود زمان نگه داشت طولانی تر شده و k’ افزایش یابد.در عمل ، بهتر است که یک k’ بین 1 و 10 داشته باشیم تا جداسازی خوبی انجام گرفته و زمان بیش از اندازه طولانی نشود.
در کروماتوگرافی صفحه ای مانند کروماتوگرافی کاغذی یا لایه نازک، تمام جداسازی های مواد حل شونده باید درون فاصله ای طی شده توسط فاز متحرک انجام شود.بنابراین مهاجرت ماده حل شونده به وسیله مقدار Rf بیان میشود که به صورت زیر محاسبه میشود.
بنابراین میل ترکیبی ماده حل شونده به فاز ثابت بیشتر باشد مقدار Rf کوچکتر خواهد شد.
کارایی =N=(efficiency)
در شرایط عالی یک جز که در حال گذر از ستون کروماتوگرافی است به شکل یک باند بسیار باریک مهاجرت میکند.با این حال غیریکنواختی جریان ، انتشار ، و اثر انتقال جرم بین ذرات و فاز متحرک سبب پهن شدن باندها میگردد.کارایی کروماتوگرافی هنگامی در بالاترین تراز خود است که پهن شدن باند به کم ترین مقدار خود برسد.کارایی ستون معمولا با N یعنی شمار پلیتهای تئوریک بیان میشود.برای یک پیک (قله) که یک منحنی زنگوله ای شکل ایجاد میکند، N به شکل زیر محاسبه میشود.
که در آن Tr زمان نگه داشت (retention time) است و ơ انحراف معیار منحنی که به صورت زمان اندازه گیری شده است.یک راه عملی برای محاسبه N بر پایه اندازه گیری پهنای پیک در نصف بیشینه ارتفاع پیک (W1/2) است. بنابراین W1/2 نمایانگر 2.354ơ است.بنابراین
افزایش در N نشانگر بهبود کارایی کروماتوگرافی و پیکهایی تیز (sharper peaks) است.کارایی بیشتر به صورت شمار پلیتهای تئوریک در طول ستون (N/L) تعریف میشود.کارایی و شمار پلیتهای تئوریک برای یک ستون بطور مستقیم با طول ستون مرتبط است اما معمولا ستونهای بلندتر زمان آنالیز بیشتری را در بر میگرند.کارایی ستون را همچنین بصورت هم ارز ارتفاع پلیت تئوریک (height equivalent of theoretical plate = HETP)بیان میکنند.
HETP = L / N
از نظر تئوری یک پلیت تئوریک ، هم ارز با طول لازم از ستون است برای برقراری یک تعادل از ماده حل شونده میان فاز ثابت و فاز متحرک.برای افزایش کارایی ستون شمار پلیتهای تئوریک باید افزایش یابد.در عمل این کار با افزایش در طول ستون انجام میشود.
سرعت جریان (flow rate) تاثیر عمده ای بر کارایی کروماتوگرافیک دارد همانطور که از برابری وان دیم تر(van deemter) برمیاید.
HETP = A + B/v +Cv
که در آن :
A= ثابت مربوط به انتشار – ادی (eddy – diffusion).
B= ثابت مربوط به انتشار طولی (longitudinal diffusion).
C= ثابت مربوط به کینتیک انتقال جرم میان فاز ثابت و فاز متحرک.
V= سرعت فاز متحرک.
کاهش مقدار HETP نمایانگر بهبود کارایی کروماتوگرافیک است، بطوری که شمار پلیتهای تئوریک در طول ستون افزایش یافته است.معادله van deemter پیش بینی میکند که مناسب سازی سرعت جریان ، شامل برقراری تعادل میان پهن شدن پیک (peak broadening) در سرعت های پایین جریان از انتشار (diffusion) و در سرعتهای بالای جریان از اثر افزایش یافته انتقال جرم میان فاز ثابت و فاز متحرک است.همچنین پیش بینی میکند که برای یک سیستم کروماتوگرافیک ویژه یک سرعت جریان مناسب بهترین کارایی را به دست میدهد.البته همیشه اثر سرعت جریان بر کارایی با اندازه گیری پهنای پیک در سرعت های مختلف جریان آزمایش میشود. در عمل معمولا علاقه ای به تعیین منحنی van deemter نیست و بجای آن به دنبال شناسایی بالاترین سرعت جریانی هستیم که به پهن تر شدن پیک نینجامد. معمول ترین هدف ،شناسایی شرایطی است که سریعترین زمان آنالیز را با بیشترین و مناسب ترین جداسازی به دست دهد.
عامل هایی که بر کارایی کروماتوگرافیک اثر میگذارند در جعبه 13-1 فهرست شده اند.
در عمل کارایی ،با بکارگیری 1) ذرات کوچکتر (smaller particles) 2) ذرات بی روزنه(nonporous particles) یا 3) یک سطح مویین پوشش داده شده (coated capillary surface) بعنوان فاز ثابت برای کاهش اثر انتقال جرم (ثابت C در معادله van deemter) بهبود پیدا میکند.این شرایط بکارگیری سرعت های بالاتر جریان را بدون پهن تر شدن پیک ولی با جداسازی هایی سریعتر را فراهم میکند.عامل محدود کننده (limiting factor) در کاهش اندازه ذرات ، افزایش مقاومت (increased resistance)در برابر جریان است و بنابراین نیاز به انجام کروماتوگرافی در فشار های بالاتر (higher pressure)می باشد.
انتخاب گری (selectivity)
انتخاب گری در جداسازی دو جز ،نمایانگر توزیع متغیر اجزای مختلف میان دو فاز از یک استخراج یا میان فاز ثابت و فاز متحرک از یک سیستم کروماتوگرافیک است.فاکتور انتخاب گری (selectivity factor = α ) برای دو جز A و B عبارت است از نسبت فاکتورهای نگه داشت (retention factor) دو جز .
با این فرض که جز B پس از A خارج میشود.در جداسازی اجزا معمولا به دنبال شناسایی شرایطی هستند که تفاوتهای متوسطی در زمانهای نگه داشت اجزا به وجود آید.به این هدف از طریق فاز متحرک ، فاز ثابت و شرایط آنالیز میتوان رسید.
یک ضریب انتخابگری بزرگ برای استخراج هایی استفاده میشود که قرار است یک جز بطور کاملا انتخابی استخراج شود.با این حال یک جز انتخابگری بزرگ در کروماتوگرافی ممکن است نیاز به تغییر در فاز متحرک یا تغییر دما در شرایط آنالیز باشد تا یتوان به جدا سازی هر دو حز در مدت زمان آنالیز دست یافت.یک α به اندازه 1.1 یا بزرگتر از آن برای دو جز نشانگر یک جداسازی کروماتوگرافیک کافی و مناسب است.
ظرفیت پیک (peak capacity)
ظرفیت پیک به بیشترین شمار تئوریک اجزای کروماتوگرافی گفته میشود که در یک آنالیز منفرد کروماتوگرافی میتوان جدا کرد.عبارتست از توزیع پیوسته پیکهای جدا شده تا چهار انحراف معیار.در عمل شمار اجزایی که جدا خواهند شد کمتر از شماری است که گمان میرود چون زمان نگه داشت اجزا به طور یکنواخت توزیع نمیشود.بنابراین ظرفیت پیک به عنوان حد بالای شمار اجزایی است که قابل جداسازی است و بعنوان سنجشی برای کارایی روش کروماتوگرافی به کار میرود.ظرفیت پیک جداسازی در روش کروماتوگرافی مایع با کارامدی بالا معمولا تا چند صد پیک است.به ظرفیت پیک بالاتر میتوان به کمک 1) افزایش طول ستون 2) کروماتوگرافی با شیب حلال 3) افزایش زمان هر بار کروماتوگرافی یا 4) افزایش کارایی کروماتوگرافی دست یافت.با اینحال میتوان با بکارگیری کروماتوگرافی دوبعدی یا چند بعدی به شکلی که بعدهای بعدی پی در پی (بعد دوم نمایانگر آنالیز بخشهای جمع آوری شده از بعد اول است ) انجام شود به ظرفیتهای بالاتری از پیک نیز دست یافت.ظرفیتهای پیک بیشتر از 10000 در HPLC دو بعدی بدست آمده است.اما نیازمند زمان آنالیز بسیار برای هر نمونه است تا در بعد دوم چندین بار کروماتوگرافی انجام گردد.اتصال روشهای کروماتوگرافی به دیگر شیوه های آنالیز یا آشکارسازها مانند اسپکترومترهای جرمی با ظرفیت تجزیه یا آشکارسازی چندین جز به عنوان یک شیوه جایگزین برای غلبه بر محدودیتهای بنیادی ظرفیت پیک کروماتوگرافی بدون افزایش زمان آنالیز بسیار خوب عمل کرده است. این روش ،آنالیز عملی تا هزار جز در یک نمونه را در بررسی های متابولومیک یا پروتئومیک امکان پذیر ساخته است.
کروماتوگرافی صفحه ای (planar chromatography)
کروماتوگرافی کاغذی (paper chromatography) و کروماتوگرافی لایه نازک (thin-layer chromatography= TLC) به عنوان تکنیکهای صفحه ای کروماتوگرافی طبقه بندی میشوند. TLC از یک لایه نازک جاذب مانند سیلیکا ژل ، میکروپارتیکل های سلولوز ، یا آلومینا که بطور یکنواخت روی یک صفحه شیشه ای ، یا ورق پلاستیک یا فویل آلومینیومی پخش شده است بهره میگیرد.نمونه به صورت یک نقطه کوچک یا یک نوار کوچک روی پلیت گزارده میشود و لبه پایین پلیت در درون فاز متحرک و نوار نمونه درست بالای فاز متحرک قرار میگیرد ، کل پلیت را در یک محفظه دربسته قرار میدهند(شکل 13-10).
پس از اینکه فاز متحرک تا فاصله مورد نظر به وسیله عمل مویینگی حرکت کرد ، پلیت از تانک برداشته شده و خشک میگردد.اجزای جداسازی شده با روشهایی مانند 1) آشکارسازی فرابنفش (فلورسنس ) 2) افشاندن ریاجنت های رنگزا و یا 3) اتورادیوگرافی تعیین محل و شناسایی میشوند.کروماتوگرافی کاغذی و TLC بیشتر برای آنالیز های کیفی بهره برداری میشوند. در این روش ها امکان جداسازی دو بعدی با بکارگیری حلال های مختلف در جهت دوم و یا امکان آنالیز موازی چندین نمونه وجود دارد.از کاربردهای این تکنیک ها میتوان به آنالیز مایع امنیوتیک برای بررسی نسبت لسیتین به اسفینگومیلین و نیز غربالگری نمونه های ادراری برای بررسی مواد افیونی و یا متابولیت هایی مانند امینو اسید ها که در بیماری های ارثی انباشته میشوند نام برد.این تکنیک ها 1) به نسبت ساده 2) بی نیاز از تجهیز های زیاد و 3) آنالیز موازی چندین نمونه را در جداسازی یک بعدی امکان پذیر میکنند.با این حال کاربردهای آن در آزمایشگاههای بالینی رو به کاهش گزارده است و آن بخاطر خودکار (automation) نشدن و ناتوانی محدود در انجام تعیین مقدار دقیق است.
کروماتوگرافی مایع (liquid chromatography)
کروماتوگرافی مایع بر پایه توزیع مواد حل شونده بین فاز متحرک مایع و فاز ثابت است .در HPLC ذره هایی با قطر کوچک به عنوان پایه فاز ثابت بکاربرده میشوند.از آنجایی که افت فشار با مجذور قطر ذره ها ارتباط دارد بنابراین فشارهایی به نسبت بالا برای پمپ کردن فاز مایع در ستونهای HPLC کارا نیاز است.به همین خاطر به این تکنینک کروماتوگرافی مایع با فشار بالا (high pressure liquid chromatography) نیز گفته میشود.این تکنیک بسیار پرکاربرد بوده و مکانیسم های جداسازی ، فازهای ثابت ،حلال های مختلف و آشکارسازهای گسترده ای در آن میتوان بکار برد.
دستگاهی کردن (instrumentation)
اجزای یک کروماتوگراف مایع در شکل 13-11 نشان داده شده است .
ستون ها (columns)
گستردگی انتخاب ستون های موجود در کروماتوگرافی مایع بخاطر مواد پرکننده (packing materials) و لوله (tube) هایی با قطر ها و طول های مختلف است.اندازه ستون بستگی به کاربرد آن دارد. اندازه ستون های باز (open) یا کم فشار (low pressure) برای کاربردهایی مانند نمک زدایی (desalting) یا در تخلیص به روش های تعویض یون یا میل ترکیبی بستگی کامل با ظرفیت (capacity) مورد نیاز در جداسازی دارد.
ابعاد ستون (column dimentions)
برای کاربرد در آزمایشگاه های بالینی بیشتر ستون های HPLC از لوله هایی از جنس استینلس استیل (stainless steel) ساخته میشوند که قطر درونی (internal diameter=ID) آنها از 0.3 mm تا 5 mm و طول آنها از 50 mm تا 250 mm متغیر است( جدول 13-1( .
بطور کلی حد آشکارسازی های پایین (low detection limit) به وسیله ستون هایی با قطر درونی کوچک به دست می آید.این ستون ها با قطر درونی کوچک از لوله (tube) هایی با سوراخ باریک (narrow-bore) ( نزدیک به 2.1 mm قطر درونی ) و یا سوراخ میکرونی (micro-bore) ( نزدیک به 1 mm قطر درونی ) ساخته شده اند. علاوه بر کارایی بالا (improved efficiency) ، ستونهای با قطر درونی کوچک از حجم کمتری از فاز متحرک نسبت به ستون هایی با قطر درونی بزرگتر استفاده میکنند. ( جدول 13-1( .
ستون های مویین (capillary columns) که در کروماتوگرافی مایع استفاده میشوند با پوشش دادن دیواره درونی یک لوله سیلیکای جوش خورده با یک پوشش نازک از فاز مایع بازسازی میشوند. قطر درونی این ستون ها از 0.1 mm تا 0.5 mm و طول آنها از 10 تا 50 cm متغیر می باشد.
فاز ثابت ستون (column stationary phase)
نوع فاز ثابت که در ستون بکار برده میشود مهمترین تعیین کننده در انتخاب گری (selectivity) و توانایی جداسازی (resolution) است.شکل فیزیکی فاز ثابت معمولا یک بستر فشرده شده (packed bed) از ذره های کوچک (small particle) یا میله های روزنه دار یک شکل و اندازه (monolithic porous rod) می باشد.
پرکردن ستون با ذرات (particulate column packing)
گوناگونی بسیاری در ذراتی که بستر فشرده شده را میسازند دیده میشود،قطر ذرات از 1.8 – 10 um متغیر است.همانطور که پیشتر گفته شد فشار معکوسی(back pressure) که به وسیله بستر فشرده شده ایجاد میشود به طور معکوس با مجذور قطر ذرات مرتبط است.بنابراین یک کاهش دو برابری در اندازه ذرات باعث افزایش چهار برابری در فشار معکوس میشود.جداسازی با فشارهای پایین از مواد پرکننده ای (packing materials)مانند دکستران ها با اتصال متقاطع و اگاروز که قطر ذره آنها از 50 تا 200 um متغیر است بهره میگیرد. بکارگیری ذرات کوچکتر کارایی جداسازی (separation efficiency) را بالاتر می برد اما در برابر آن مقاومت بالاتری مقابل جریان حلال ایجاد میشود و نیاز به فشارهای بالاتری برای عمل کردن سیستم است.بکارگیری ستون هایی با ذرات دارای قطر کوچک منتهی به ساخت نسل نوینی از سیستم های HPLC گردیده است که با فشارهایی نزدیک به 1000 bar( 15000 psi) کار میکنند که در حدود دو تا سه برابر بیشتر از سیستم های HPLC پیشین است.فشارهای بالاتر سبب تغییرهایی درباره فشارپذیری حلال (compressability of solvent) و زمان های نگه داشت (retention times) میشود.
انواع پر کردن ذرات (particulate packing) شامل 1) متصل شده (bonded) 2) پلی مری (polymeric) 3) کایرال (chiral) 4) مواد با دسترسی محدود (restricted access materials) می باشند.
Bonded phase packing: دراین نوع از پرکردن ، فاز ثابت به صورت شیمیایی به سطح ذرات سیلیکا از طریق اتصال استر سیلیکا (silica ester linkage) یا اتصال پلی مری سیلیکون متصل میگردند.پر کردن به شیوه فاز متصل 1) از نظر مکانیکی و شیمیایی پایدار است 2) طول عمر زیادی دارد 3) کارامدی کروماتوگرافی بسیار خوبی دارد.از این روش پرکردن در کروماتوگرافی تعویض یون و کروماتوگرافی فاز نرمال (norma phase chromatography) و کروماتوگرافی فاز معکوس (reversed phase chromatography) استفاده میشود.در HPLC فاز نرمال، گروه های عملکردی فاز ثابت قطبی (polar) هستند در برابر گروه های غیر قطبی (nonpolar) فاز متحرک مانند هگزان .نمونه هایی از گروه های عملکردی قطبی در HPLC فاز نرمال، شامل سیلانول ، آمینو ، و گروه های نیتریل است.HPLC فاز معکوس نیاز به فاز ثابت غیر قطبی دارد.دوست داشتنی ترین ستون فاز معکوس نوع C18 است که در آن مولکولهای اکتادسیل سیلان (octadecylsilane) به ذرات سیلیکا متصل میشوند.ویژگی های نگه داشت و انتخاب گری ستون های فاز معکوس با اتصال دیگر گروه ها مانند اکتیل (octyl) ، فنیل (phenyl) ، یا سیانوپروپیل (cyanopropyl) به سیلیکا تغییر میکند.
پرکردن پلی مری (polymeric packing):کربن گرافیتی شده یا کوپلی مرها ( مانند پلی استایرین – دی وینیل بنزین )در روش پرکردن پلی مری بطور مستقیم و یا اینکه بصورت بیشتر مشتق شده با گروه های عملکردی تعویض یون و یا گروه های عملکردی 4 کربنه یا 8 کربنه یا 18 کربنه استفاده میشوند.کارامدی ستون هایی که با این روش پر میشوند قابل مقایسه با ستون هایی است که برپایه سیلیکا هستند، این ستون ها هم در بازه pH 2 تا 13 پایدار هستند.
Chiral packing: از پر کردن کایرال برای جداکردن انانتیومر (enantiomer) ها که شکل های آینه ای یک ترکیب به شمار میروند استفاده میشود.در آزمایشگاه بالینی از این نوع پرکردن برای جدا سازی و تعیین مقدار انانتیومرهای مواد افیونی استفاده میشود.
Restricted access packing: در پرکردن دسترسی محدود ، سطح بیرونی ذرات پایه با یک شبکه آبدوست (hydrophilic network) محافظت میشوند. مواد حل شونده کوچک مانند داروها از طریق این شبکه به درون سوراخ هایی وارد میشوند که با فاز ثابت آبگریز پوشانده شده اند.مولکولهای پروتیینی بزرگ به این هسته های درونی دسترسی نداشته و از ستون میگذرند. این نوع ستون ها تزریق نمونه های بیولوژیکی را با غلظت پروتیینی بالا فراهم میکند. این نوع پرکردن آماده سازی نمونه را دور زده صحت آنالایتیکال را بهبود میبخشد.
ستون های مونولیتیک (monolithic columns) : در برابر ستون هایی که با ذرات جدا پر میشوند ستون های مونولیتیک ،استوانه هایی از میله های مونولیتیک بر پایه سیلیکا یا پلیمر هستند.چنین ستونهایی ساختارهای روزنه ای دو شکلی دارند شامل سوراخ های بزرگ (نزدیک به 2 um قطر) که چگالی روزنه ای بالایی را فراهم کرده و سوراخ های کوچک (نزدیک به 13 nm قطر) که سطح درونی بسیار بزرگی را ایجاد میکنند.نشان داده شده که این نوع ستون ها توان جداسازی بسیار سریعی را دارا هستند به این خاطر که سرعت جریان بالاتری را نسبت به ستون های ذره ای در فشار معکوس های منطقی میتوانند داشته باشند. علاوه بر آن این ستون ها قادر به انتقال سریع جرم بوده و از ظرفیت اتصال بالایی برخوردارند.فشار معکوس های پایین ویژگیهای تکرارپذیری در ستون را افزایش میدهد چون بسیاری از عامل هایی که ستون های ذره ای را از بین میبرد(مانند فشرده شدن به سمت انتها (packing down) و ایجاد کانال(channeling) در ستون ) حذف میشود.میله های مونولیتیک در لوله ای از ماده خنثی پلی تترا فلوئورواتیلن (polytetrafluoroethylene) بسته بندی شده(encased) و کل این ساختار در یک محفظه (housed)استینلس استیل قرار داده میشود.این لوله از ماده خنثی void volume میان لوله استینلس استیل و میله های مونولیتیک را برطرف ساخته و به این وسیله توانایی جداسازی افزایش میابد.دو مزیت دیگر این ستون ها این است که از آنها میتوان با شیب های جریان فاز متحرک (برای نمونه افزایش در سرعت جریان در پایان جداسازی ایجاد کرد) استفاده کرد و دیگر این که چندین ستون را میتوان با یکدیگر جفت کرد و توانایی جداسازی را با کمترین افزایش در فشار معکوس جریان بهبود بخشید.ستون های مویین مونولیتیک هم در دسترس است.
از کاربردهای بالینی این نوع ستون ها در جداسازی فاز معکوس پپتیدها و پروتیین ها است.
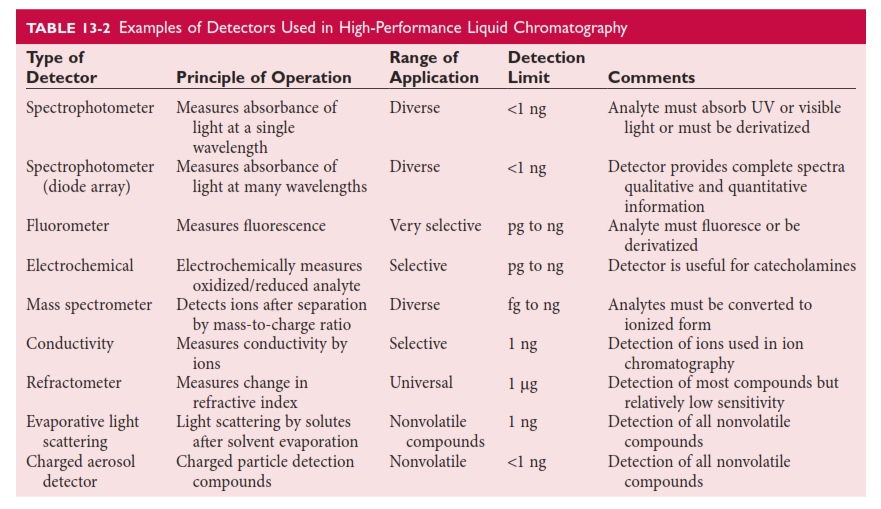
آشکارسازها (detectors)
چندین نوع آشکارساز مختلف در کروماتوگراف های مایع بکار گرفته میشوند (جدول 13-2( .بخش کلیدی و مرکزی این آشکارسازها همان سلول جریان (flow cell) در این آشکارسازها است که از میان آن ماده گذرنده (eluate) از ستون کروماتوگرافی میگذرد.آنالیتهای حل شده آشکارسازی شده و یک سیگنال الکترونیکی تولید میشود.
در عمل آشکارسازها یا بصورت تکی و یا بصورت متصل در یک سری استفاده میشوند. علاوه بر این واکنشگرهایی پس از ستون و پیش از آشکارساز (postcolumn reactors) ممکن است در نظر گرفته شود تا یک واکنش شیمیایی همانند واکنش نینهیدرین (ninhydrin) با امینو اسیدها انجام گیرد تا مجصولهایی با سیگانالهای قوی تر و اختصاصی تر تولید شوند.
فتومترها و اسپکتروفتومترها (photometers and spectrophotometers)
فتومترهای فرابنفش و مریی انررژی تابشی جذب شده به وسیله ترکیب ها را در هنگامی که آنها از ستون کروماتوگرافی میگذرند ،اندازه گیری میکند(فصل 10).این آشکارسازها در گستره 190 – 400 nm و 400-700 nm عمل میکنند.این تجهیزها بسیاری از مواد حل شده را به آسانی اندازه گیری میکنند چون ترکیبات آروماتیک (aromatic) در گستره فرابنفش از 250-300 nm و بسیاری از ترکیبهای دیگر مانند آمیدها (amides) ،کربوکسیلیک اسیدها (carboxylic acids) و دیگر گروه ها جذب خوبی در گستره 190-220 nm دارند.
فتومترها به دو شکل آشکارسازهای طول موج ثابت (fixed wavelength detector) و آشکارسازهای طول موج متغیر (variable wavelength detector) عمل میکنند.بیشتر فتومترهای فرابنفش طول موج ثابت از طول موج 254 nm که به وسیله یک لامپ جیوه تابش میشود بهره میگیرند.این نوع آشکارسازها بسیار حساس بوده و توانایی اندازه گیری تا 0.005 واحد جذب را دارا هستند. به شیوه ای دیگر از فسفر استفاده میکنند و آنرا بین لامپ و سلول گذاشته و فلورسانس تابش شده از تحریک (excitation) 254 nm به عنوان منبع نور استفاده میشود.این روش در فتومترهای با دو طول موج ثابت استفاده میشود (254 و 280 nm).طول موجهای 214 nm و 229 nm که به ترتیب به وسیله لامپهای زینک و کادمیوم تابش میشوند برای آشکارسازی در طول موجهای پایین استفاده میشوند.
نوع دوم فتومترها آشکارسازهای طول موج متغیر هستند.این نوع آشکارسازها در یک طول موج گزینش شده از یک گستره طول موجی کار میکنند.بنابراین آشکارساز طوری تنظیم میشود تا در جذب بیشینه یک آنالیت یا گروهی از آنالیتها عمل کند این کاربرد و انتخاب گری آشکارساز را افزایش میدهد.برتری دیگر این آشکارساز توانایی عمل کردن آن در طول موجهای پایین (مثلا 190nm) است.چون بیشتر ترکیب ها (مثلا کلسترول ) درطول موجهای پایین جذب دارند این توانایی کاربرد آشکارساز را افزایش میدهد.با این حال درطول موجهای پایین بسیاری از حلال ها نور فرابنفش را جذب میکنند و نمیتوان از آنها بعنوان فاز متحرک استفاده کرد.خوشبختانه استونیتریل و متانول دو تا از حلالهای پرکاربرد در کروماتوگرافی فاز معکوس جذبهای پایینی در 200 nm دارند.
آرایه دیودی (Diode Array) نیز بعنوان آشکارسازهای HPLC استفاده میشوند چون بسرعت داده های طیفی را در همه گستره طول موجی از 190-600 nm در عرض 10 ms به دست میدهند.درطی عمل آشکارساز آرایه دیودی نور پلی کروماتیک (چند رنگی ) را از فلوسل (سلول) آشکارساز عبور میدهد سپس نور گذر کرده به وسیله یک گریتینگ انکساری (defraction grating) پراکنده شده و به سوی یک آرایه فتودایودی هدایت میشود در اینجا شدت نورها در چندین طول موج از طیف اندازه گیری میشوند.این نوع آشکارسازها در شناسایی داروها در ادرار و سرم پرکاربرد بوده اند.
در عمل لازم است که ازحلال ها ،عامل های جفت کننده یون (ion pairing agents) و بافرهایی با جذب پایین در طول موجهای مورد علاقه استفاده کرد تا سیگنال پس زمینه پایینی داشته باشیم.آب ،استونیتریل، متانول ،ایزوپروپانول و هگزان حلالهایی هستند که آشکارسازی را با نور فرابنفش درطول موجهایی کمتر از 200nm همانند بافرهای فسفات فراهم میکنند.بسیاری از حلالها و بافرهای دیگر دربازه فرابنفش جذب چشمگیری داشته و آشکارسازی با نور فرابنفش را محدود میسازند.همچنین از فلوسل هایی با حجم پایین در HPLC استفاده میکنند تا پهن شدن باندها رخ ندهد.
مشکلی که در کار با آشکارسازهای فتومتری وجود دارد بیرون آمدن گاز از حلال در طی خروج آن از ستون تحت فشار و وارد شدن آن به فلوسل آشکارساز تحت فشار پایین است.از آنجایی که این آشکارسازها بسیار حساس هستند این حبابها را به عنوان نویز شناسایی کرده و سبب ازبین رفتن نسبت سیگنال به نویز آشکارساز میشوند.از بین بردن گاز (degassing) حلال ها بطور موثر سبب کاهش تشکیل حباب ها میگردد.
فلورومترها . همانطور که در فصل 10 گفته شد فلوروسنس زمانی رخ میدهد که یک مولکول نور را در یک طول موج جذب میکند و دوباره نور را در یک طول موج بلند تر گسیل میکند.فلورومترهای برخط درکروماتوگراف های مایع استفاده میشوند تا ترکیبهای فلورسانس کننده را هنگامی که از ستون خارج میشوند شناسایی کنند.آشکارسازهای فلورسانس بطور کلی از انواع فتومتریک حساستر هستند.و دیگر این که راکتورهای پیش از ستون و پس از ستون درآنها بکار رفته تا بطور شیمیایی یک ترکیب را با یک لیبل فلورسنت به منظور آشکارسازی درانتها نشاندار کنند.برای مثال آمینواسیدها و دیگر آمین های نوع اول با دانسیل (dansyl) یا fluorescamine نشاندار شده و به دنبال آن حداسازی و آشکارسازی فلورومتریک در HPLC انجام میشود.بیشتر فلورومترهای بکار رفته در کروماتوگرافهای مایع درساختار ساده و بسیار انتخابی و حساس به ترکیبهای هستند که در گستره طول موجی آشکارساز عمل میکنند.لامپهای گدازشی یا لیزری دوتریوم یا زنون به عنوان منبع نور در این آشکارسازها بکار رفته اند.
آشکارسازهای الکتروشیمیایی (electrochemical detectors)
در آشکارسازهای الکتروشیمیایی آمپرومتریک (فصل های 11 و 30 راببینید) یک آنالیت فعال از نظر الکتروشیمیایی (electroactive analyte) وارد فلوسل میشود که در آنجا ممکن است در سطح الکترود با پتانسیل ثابت اکسید (oxidized) شده یا کاهش (reduced) یابد.استفاده از چندین الکترود و تغییرهای چرخشی در ولتاژ آشکارسازی چندین ترکیب را در پتانسیل های مختلف میدهد و همزمان پاکسازی چرخشی الکترودها نیز انجام میشود.ترکیبهای الکترواکتیو با اهمیت بالینی که با HPLC و آشکارسازی الکتروشیمیایی شناسایی میشوند شامل کاتکول آمین های ادراری و ترکیبهای دارای تیول مانند هوموسیستئین و آسکوربیک اسید است.همچنین برچسبهای فعال از نظر الکتروشیمیایی مانند برومین (bromine) به ترکیبهایی مانند اسیدهای چرب غیر اشباع یا پروستاگلاندین ها افزوده میشوند.
آشکارسازهای کولومتریک نیز استفاده میشوند.هنگامی که چنین آشکارسازهایی به شکل یک سری قرار میگیرند میتوانند ترکیبهایی که همزمان خارج میشوند (coeluting compounds) و در نیم موج پتانسیل = half wave potential ( میزان پتانسیل در نصف سیگنال بیشینه ) خود تا دست کم 60mV متفاوت هستند را شناسایی و تعیین مقدار کنند.این آشکارسازها بسیار انتخابی و حساس بوده و گستره پاسخ خطی وسیعی دارند.از این آشکارسازها در آزمایشگاه بالینی برای اندازه گیری متانفرین ها(metanephrines)- وانیلیل مندلیک اسید(vanilylmandelic acid)-هومووانیلیک اسید(homovanillic acid)- 5 هدروکسی ایندول استیک اسید(5-hydroxyindol acetic acid) در ادرار انسان بدون هیچ فراوری دیگری روی نمونه استفاده میشوند.
آشکارسازهای بر پایه هدایت الکتریکی (conductivity detectors) نیز برای پیگیری شیب ترکیبهای نمکی متغیر درکروماتوگرافی تعویض یون استفاده میشوند.کاربرد دیگر این آشکارسازها درکروماتوگرافی یون ها است.خروج یونهای خارج شده درکروماتوگرافی تعویض کاتیون یا تعویض آنیون را میتوان با حساسیت بالا شناسایی کرد.هدایت الکتریکی یک یون خاص با غلظت(concentration) و بار الکتریکی(charge) و حرکت(mobility) آن ارتباط دارد.این فناوری برای آنالیز یونهای آلی و غیرآلی کوچک که موبیلیتی بالایی دارند مناسب است مانند اندازه گیری سولفات در مایع های زیستی اما کاربرد اصلی آن بیشتر غیربالینی است.
آشکارسازهای ضریب شکست (refractive index detectors).این آشکارسازها تغییر در شکست نور را هنگامی که مواد حل شونده از میان فلوسل میگذرند احساس میکنند.این آشکارسازها ابزاری برای تشخیص موادی مانند الکل ها – پلی اتیلن گلایکول – نمکها – و قندها هستند که جذب کمی درطول موجهای معمول در آشکارسازی های اسپکتروفوتومتری دارند.
اسپکترومتری جرمی (mass spectrometry).همانطور که پیشتر گفته شد هنگامی که یک گاز کروماتوگراف یا یک کروماتوگراف مایع به یک اسپکترومتر جرمی وصل میشود به این تکنیک های ترکیبی گاز کروماتوگرافی – اسپکترومتری جرمی (gas chromatography-mass spectrometry = GC-MS) و کروماتوگرافی مایع – اسپکترومتری جرمی (liquid chromatography-mass spectrometry = LC-MS) گفته میشود .این فناوری ها بسیار حساس و اختصاصی بوده و کاربرد فزاینده ای در آزمایشگاه های بالینی و تحقیقاتی و در زمینه های ترکیبی مانند پروتئومیکس (proteomics) دارند.در بسیاری از کاربردها بعلت اختصاصیت بالای تاندم مس اسپکترومتر(tandem mass spectrometer) مرتبه های HPLC بسیار کوتاهی لازم است و بیشتر ترکیب ها لازم نیست که بطور کامل جدا شوند.
بخش مهم در اتصال یک GC یا یک HPLC به یک اسپکترومتر جرمی نقطه رویارویی بین آنها (interface) است .برای مثال نقطه رویارویی بین کروماتوگراف مایع و اسپکترومتر جرمی چالش برداشت مولکولهای حلال و انتقال ترکیب ها از محلول مایع و تبدیل آنها به شکل باردار در خلا ، برای آنالیز توسط اسپکترومتر جرمی را دارد.بنابراین همه بافرهای بکار رفته در کروماتوگرافی نیاز است که تبخیر شوند تا از بارگذاری بیش از حد (overloading) و آلوده شدن محل رویارویی جلوگیری شود.به همین علت یک دریچه سویچ کننده نیز بکار رفته تا نمک ها و دیگر ترکیبهای دست نخورده را که زودتر خارج میشوند به سمت ضایعات رهنمون کند.
دیگر آشکارسازها.شمار دیگری از آشکارسازها نیز در کروماتوگرافهای مایع استفاده شده اند اما بیشتر برای کاربردهای تحقیقاتی.آشکارسازهای پراکنش نور دینامیک (Dynamic light scattering detector)پراکنش نور مرتبط با اندازه مولکولی را اندازه گیری میکنند که در تعیین ویژگی و اندازه مولکولها و کمپلکس ها بسیار مفید بوده است.تشدید مگنتیک هسته (nuclear magnetic resonance) روی نمونه هایی که از فلوسل میگذرند انجام شده است و در کاربردهای مانند آنالیز لیپوپروتیین،متابولومیکس،و تعیین ویژگی متابولیتهای داروها مفید بوده است.
گونه های جدید از آشکارسازها نیز ساخته شده اند که یک روش آشکارسازی جهانی را برای ترکیبهایی که تبخیر شدنی نیستند فراهم کرده اند.برای مثال با آشکارساز پراکنش نورتبخیری (evaporative light scattering detector) حلال با افشانده شدن پساب کروماتوگرافیک با یک جریان گاز تبخیر میشود.مواد حل شده تبخیرنشدنی به شکل ذرات در جریان گاز باقی میمانند و این ذرات با اندازه گیری پراکنش نور در یک زاویه از نور برخوردی شناسایی و اندازه گیری میشوند.پراکنش نور متناسب با جرم مواد تبخیر نشدنی است.حد تشخیص نزدیک به 1 ng برای گلوکز به دست آمده است.کاربردهایی مانند این در آنالیز لیپیدها، قندها، و دیگر ترکیبها که به روش نورسنجی آنالیز آنها سخت است انجام شدنی است.نوع دوم از آشکارسازهای تبخیری آشکارساز ذره باردار(charged aerosol detector) است که مواد حل شونده را یونیزه میکند سپس بجای اندازه گیری پراکنش نوری جریان یونی را اندازه گیری میکند. این روش برای بیشتر ترکیبها بسیار حساس است. یک عیب آشکارسازهای تبخیری این است که آنها نمونه را تخریب میکنند و دیگر این ترکیبها را نمیتوان جمع آوری کرد تا آنالیز بیشتری روی آنها انجام داد.
کروماتوگرافی مایع فرابحرانی (supercritical fluid chromatography)
دی اکسید کربن تحت فشار به شکل مایع است و چند ویژگی مفید به عنوان حلال در کروماتوگرافی دارد.چسبندگی پایین و ضریب انتشار بالا داشته و بسیاری از ترکیبهای آب گریز را درخود حل میکند.این تکنیک ویژگیهای کارامدی مابین کروماتوگرافی مایع و گازکروماتوگرافی دارد.از این تکنیک برای آنالیز لیپیدها و دیگر ترکیبهای آب گریز که در دی اکسید کربن مایع حل میشوند استفاده میشود.این تکنیک به دلیل نیاز به تجهیزهای ویژه در کابردهای بالینی استفاده کمتری داشته است.
گاز کروماتوگرافی (gas chromatography = GC)
GC اول بار توسط james و martin در سال 1952 برای جداسازی اسیدهای چرب استفاده شد.با این تکنیک از یک فاز متحرک گازی استفاده میشود تا مخلوطی از مواد حل شونده فرار را از یک ستون دارای فاز ثابت بگذرانند.فاز متحرک یک گاز خنثی است مانند نیتروژن ،هلیوم ،هیدروژن یا آرگون که به آن گاز حامل هم میگویند.جداسازی مواد حل شونده بر پایه تفاوت نسبی در فشار بخار مواد حل شونده و برهم کنش آنها با فاز ثابت است.بنابراین یک ماده حل شونده بسیارفرار پیش از یک ماده کمتر فرار از ستون خارج میشود.بعلاوه یک ماده ای که بطور انتخابی با فاز ثابت برهم کنش میدهد پس از ماده حل شونده ای خارج میشود که برهم کنش کمتری با فاز ثابت دارد.پساب ستون مواد حل شونده جدا شده را به ترتیب زمان خروجشان به سوی آشکارساز میبرد.مواد حل شونده بصورت کیفی از روی زمان نگه داشتشان شناسایی میشوند. و دیگر اینکه اندازه پیک (سطح یا بلندا) متناسب با مقدار ماده حل شونده است و برای اندازه گیری آن استفاده میشود.
گاز-جامد کروماتوگرافی (gas-solid chromatography = GSC) و (gas-liquid partition chromatography=GLC) زیرگونه هایی از GC هستند.در GSC جداسازی در اصل از طریق تفاوت در جذب در سطح فاز جامد انجام میشود.در GLC یک مایع غیرفرار روی ذرات ستون پوشانده (coated) و یا بصورت شیمیایی به ذرات متصل (bonded)میشود و یا اینکه در ستون های مویین به دیواره آن ، بطور مستقیم این فرایندها انجام میشود.جداسازی در اصل از طریق تفاوت در توزیع ماده حل شونده بین فاز متحرک گازی و فاز ثابت مایع انجام میشود.
دستگاهی کردن (instrumentation)
بخش های یک گاز کروماتوگراف در شکل 13-12 نمایش داده شده است.
شکل 13-12
ستون ها
هر دو نوع ستون فشرده (packed) و مویین (capillary) درگاز کروماتوگراف ها بکارگرفته میشوند.ستون های فشرده شده با ذرات پایه پر میشوند که یا بصورت پوشش داده نشده (uncoated) (GSC) و یا بصورت پوشش داده شده (coated) یا شیمیایی متصل شده (chemically bonded) با فاز جامد (GLC) استفاده میشوند.چنین ستونهایی از 1 تا 4 میلی متر قطر درونی و از 1 متر به بالا درازا دارند و از لوله های شیشه ای یا استینلس استیل ساخته شده اند.اگر چه ستونهای باریک بیشتر کارامد هستند اما ستونهای پهن توانایی نمونه گذاری بیشتری دارند.
انواع ستون های مویین شامل 1) porous layer open tubular (PCOT) 2) support coated open tubular (SCOT) 3) wall-coated open tubular ( WCOT) می باشد. در ستون های PCOT یک لایه پرروزنه در دیواره درونی وجود دارد. روزنه دار کردن یا به روشهای شیمیایی (etching) یا به روش رسوب گذاری (deposition) ذرات روزنه داراز یک مخلوط(suspension) روی دیوار درونی ستون ایجاد میشود.این لایه پرروزنه روی دیوار یا به عنوان پایه برای یک فاز ثابت مایع و یا بعنوان خود فاز ثابت استفاده میشود.
ستونهای SCOT دیوار درونی خود را دارند که با یک لایه نازک از مواد پایه ، پوشانده شده که بر روی آن فاز ثابت جذب (adsorption) میشود.ستونهای WCOT از یک لوله مویین ساخته شده که دیوار درونی آن با یک فاز ثابت مایع پوشانده شده است.این ستونها دوست داشتنی ترن ستونها بین سه نوع ستون مویین دیگر هستند و با پوشش دادن دیوار درونی آنها با یک لوله سیلیکای جوش خورده (fused silica) که قطر درونی و درازای آن به ترتیب از 0.1 – 0.5 mm و از 10-150 m متفاوت است ساخته شده است.لوله کردن مویین سیلیکای جوش خورده بسیار خالص ،خیلی شکننده است و برای محکم کردن آن از نظر فیزیکی یک پوشش بیرونی نازک از پلی ایمید (polyimide) یا الومینیوم افزوده میشود که پایداری ستون را افزایش میدهد.این ستونهای مویین اصلاح شده استحکام ساختاری و انعطاف پذیری مورد نیاز برای دوام آوردن در برابر پیچش (coiling) وجایگیری در اوون (oven) ها را دارند.
پیشرفتهایی در ساخت ستونهای micro GC روی چیپ های سیلیکون انجام شده است.این ریزدستگاه ها توان بسیار زیادی برای کروماتوگرافی گازی با سرعت بالا (high speed GC) و GC مینیاتوری و حتی GC جیبی (pocket GC) دارند.
شماری از ترکیب ها به عنوان فاز ثابت در GLC استفاده شده اند .این ها شامل 1) پلیمرهای متیل سیلیکون (methyl silicon polymers) 2) پلیمرهای سیلیکون جانشین دار شده (substituted silicon polemers) 3) پلی استرهای سیلیکون (silicon polyesters) . (جدول 13-3( را ببینید.این مواد یا پوشش داده میشوند با روی سطح مواد پایه (support material) و یا برروی دیوار ستون بصورت شیمیایی متصل میگردند .اگرچه این ها گرانتر هستند اما مواد متصل شده بخاطر پایداری شان ترجیح داده میشوند.
منبع گاز حامل (carrier gas supply) و کنترل جریان (flow control)
عملکرد منبع گاز حامل و کنترل جریان فراهم کردن گاز حامل برای ستون کروماتوگرافی و تنظیم جریان آن در سیستم است.از نظر عملکردی یک جریان ثابت از گاز حامل برای کارایی ستون و تکرارپذیر بودن زمانهای خروج مواد، لازم است.سیستم هایی که جریان ثابت ایجاد میکنند از دستگاه های مکانیکی گرفته تا انواع الکترونیک شامل میشوند.در بیشتر عملکردهای قابل برنامه ریزی در دمای مورد نظر یک کنترل کننده جریان مانند یک سیستم کنترل کننده الکترونیک فشار و قابل برنامه ریزی ،برای تنظیم جریان گاز و فشار در طی کروماتوگرافی مورد نیاز است.چنین کنترل کننده ای ممکن است یا به شکل جریان ثابت (constant flow) یا به شکل فشار ثابت (constant pressure) عمل کند.در حالت جریان ثابت ٰ،فشار مورد نیاز برای برقراری جریان ثابت مستقل از چسبندگی گاز حامل محاسبه میشود و آنگاه یک ترانسدیوسر فشار، فشار مورد نیاز برای جریان ثابت را اندازه گیری کرده و برقرار میسازد.
بزرگی سرعت جریان گاز حامل بستگی به نوع ستون دارد.برای مثال ستون های فشرده شده (packed column) نیاز به سرعت جریان 10-60 ml/min دارند.برای ستونهای مویین خیلی کمتر 1-2 ml/min مورد نیاز است و برقراری یک جریان ثابت برای کارامدی عملکرد این ستونها بسیار مهم است.
شماری از گازها را به عنوان گازهای حامل که بستگی به ستون و آشکارساز دارد بکار میبرند.هیدروژن و هلیوم گازهای حامل انتخابی درستون های مویین هستند.تنها گازهای هیدروژن و هلیوم بسیار خالص باید استفاده شوند چون ناخالصی گاز 1) به ستون اسیب میزند 2) بر کارایی برخی آشکارسازها اثر منفی میگذارد 3) در اندازه گیری های مقدارهای ناچیز اثر منفی دارند.در ستونهای نوع فشرده گاز حاملی که بیشتر استفاده میشود نیتروژن است که با آشکارسازهای نوع flame ionization (FID) - electron capture(ECD) – و thermal conductivity (TCD) استفاده میشوند.گاز هلیوم با FID و TCD و مخلوط گازهای نیتروژن و ارگون با ECD استفاده شده اند.
کنترل دما (temperature control)
از نظر عملکردی هر دو نوع ستون فشرده و مویین نیازمند کنترل دقیق دمای ستون ،تزریق کننده و آشکارساز هستند.کنترل دمای ستون با جایگذاری ستون در یک اون (کوره) و یا گرمادهی ستون با یک گرماده مقاومتی انجام میشود.تزریق کننده و آشکارساز معمولا به وسیله گرماده مقاومتی الکتریکی کنترل میشوند.بسته به کاربرد،دمای ستون یا در یک دمای ثابت از پیش تعیین شده (isothermal operation) در طی کروماتوگرافی قرار میگیرد یا بصورت تابعی از زمان (temaperature programmed or temperature gradient) .
در عمل گرمادهی ستون به شکل دمای برنامه ریزی شده (temperature programmed) در بیشتر کاربردهای بالینی انجام میشود.در شکل دمای برنامه ریزی شده مواد حل شونده ای که نقطه جوش پایین تری دارند اول از ستون خارج میشوند و به دنبال آنها آنهایی که نقطه جوش بالاتری دارند.به این ترتیب یک مخلوط پیچیده ای از مواد حل شونده با طیف گسترده ای از نقطه جوش های مختلف به شکل قله های مشخص و نوک تیز کروماتوگرافی در مدت زمان کمتری نسبت به دمای ایزوترمال جدا میشوند.دما به وسیله یک کامپیوتر و نرم افزار مربوط به دلخواه برنامه ریزی میشود.
درکروماتوگراف های گازی مویین کنترل دقیق و درست دمای تزریق کننده و ستون برای عملکرد مناسب و گرفتن نتایج قابل اعتماد ضروری است.کنترل دما به ویژه برای ستون بسیار مهم است چون در کاربردهای کیفی ،زمان نگه داشت و حجم قله های خروجی با آنچه که برای استانداردهای معتبر است برای شناسایی ترکیب ها با هم مقایسه میشود.یک تغییر 1 درجه سانتی گراد سبب 5% تغییر در زمان نگه داشت میشود. دیگر اینکه ناپایداری دمای ستون برزمان نگه داشت یا حجم قله های خروجی و مقایسه آنها بین دستگاه ها یا بین مقدارها در نوشتارها ، اثر بد میگذارد.
پایداری دمایی (thermal stability) فاز ثابت نیز بسیار مهم است.از آنجایی که هر فاز ثابت یک بازه ای از پایداری دمایی دارد مهم است که دمای ستون بین بازه عملکردی تعیین شده کنترل شود.برای فازهای غیرقطبی بازه دمایی به وسیله پایداری پوشش پلی ایمید تعیین میشود.ستون هایی با پوشش آلومینیومی به طور قابل توجهی بازه دمایی را گسترده تر کرده اند.اکسیداسیون در دماهای بالاتر ، دمای عملکردی واسطه ها را در فازهای قطبی محدود کرده است.
پیش از آنکه هر ستون استفاده شود از نظر دمایی به شیوه گرما دادن ستون در دماهای مختلف به مدت زمان های مختلف باید آماده سازی (thermal conditioning) شود.این کار باعث میشود که آلاینده های فرار شامل منومرهای بجامانده در فاز ثابت پلی مری حذف شوند.دیگر اینکه آماده سازی دمایی ستون های استفاده شده آلاینده های غیرفرار انباشته شده را که سبب خط های پایه (baselines) ناپایدار میشوند را نیز حذف کند.برای آماده سازی ستون از نظر دمایی آن را از آشکارساز جدا میکنند و برای دست کم 5 دقیقه با گاز حامل خالص پاک سازی (purge) میکنند.سپس تا دمای بالای 50 درجه سانتی گراد گرما داده میشود.این آماده سازی دمایی ستون از طریق یک برنامه دمایی با سه یا چهار تکرار انجام میشود.یا به روشی دیگر ستون را در بیشینه دمای عملکردی آن به مدت 12 تا 24 ساعت میگذارند.آماده سازی دمایی ستون ها در دماهای پایین تر عمر ستون ها را افزایش میدهد اما به زمان های بیشتری برای این کار نیاز میشود تا به پایداری خط پایه مناسب دست یافت.
آشکارسازها (detectors)
شمار زیادی از آشکارسازهای حساس به همراه گازکروماتوگراف ها استفاده میشوند (جدول 13-4).این ها شامل واحد های جهانی هستند که بیشتر آنالیت ها را شناسایی میکنند و دستگاه های بی اندازه انتخابگری که تنها گونه های خاصی را شناسایی میکنند.نمونه هایی از آنها شامل 1) FID 2) thermionic selective detector (TSD) 3)ECD 4) photoionization detector(PID) 5)TCD و 6) اسپکترومترهای جرمی. دستگاه های دیگری نیز به عنوان آشکارسازهای GC استفاده شده اند و این نیز یک کار معمول شده که دو یا چند آشکارساز را به شکل سری قرار بدهند تا اختصاصیت و حساسیت آنالیتیکال را افزایش دهند.
Flame ionization detector (FID).این نوع آشکارساز یک نوع بسیار معمول در آزمایشگاه های بالینی است.کاربرد معمول آن آنالیز اتانول و دیگر مواد فرار در خون و نمونه های مایع است.کروماتوگرام های مواد فرار که با این نوع آشکارساز شناسایی شده اند در شکل 13-13 نشان داده شده اند.برتری های این نوع آشکارساز سادگی ،قابل اعتماد بودن، پرکاربردی و آسانی کار با آن است.در طی کار مواد خروجی ستون (column effluent) با هیدروژن و هوا مخلوط میشوند و ترکیب های خارج شونده به وسیله یک شعله سوزانده میشوند.نزدیک به یک مولکول در 10000 مولکول یک کاتیون آلی (organic cation) تولید میکند و یک الکترون آزاد میکند که این الکترون به وسیله یک الکترود گردآوری کننده (collector electrode) که بالای شعله جا گرفته است شناسایی میشود.بزرگی جریان (current) ایجاد شده متناسب است با جرم ماده کربنی که به سوی آشکارساز آمده است.پس از اندازه گیری از این جریان ایجاد شده برای شناسایی و تعیین مقدار مواد حل شده خارج شونده استفاده میشود.
Thermionic selective detector. این نوع آشکارساز به عنوان آشکارساز نیتروژن – فسفر (NPD) نیز شناخته میشود که یک نوع اصلاح شده از FID است و در آن یک دانه قلیایی (alkali bead) بصورت الکتریکی درست بالای جت (jet) گرما داده میشود. در حضور اتم های قلیایی در شعله ترکیب هایی که دارای نیتروژن هستند و ترکیب هایی که دارای فسفر هستند به ترتیب 15 و 300 برابر سیگنال ایجاد میکنند.این نوع آشکارساز در آزمایشگاه های بالینی برای شناسایی اسیدها و بازهای آلی به فراوانی به کار گرفته میشوند.
منبع:تیتز پایه های شیمی بالینی و تشخیصهای مولکولی،ویرایش پنجم،فصل سیزدهم
,Tietz; textbook of clinical chemistry and molecular diagnostics ,fifth edition,chapter13























ممنون از مطلب جامع و مفیدی که درباره کروماتوگرافی نوشتید. من یک مقاله درباره اصول و اجزای دستگاه GC و کاربردهای آن منتشر کردهام که شاید برای علاقهمندان مفید باشد.