فصل ششم - آزمایش های عملی
فصل 6
ازمایشات عملی
هدف این فصل بیان اصول الایزا است با 1) نشان دادن مثالهای کارشده از سنجشها شامل دیاگرام پلیت ها و داده های نمایشی از سنجش ها 2) تحلیل چنین داده هایی بصورت قوانین مهم که باید یاد گرفته شوند 3) فراهم کردن دستور کاری برای محققین تا بتوانند سنجش خود را انجام دهند وداده های خود را جهت تحلیل بدست اورند.
این فصل از چند جنبه میتواند کاربردی باشد.اول اینکه محققینی که به ریاجنتها دسترسی ندارند میتوانند یک دانش کاری از طریق این مثالها بدست آورند.دوم اینکه برای دوره های اموزشی که ریاجنتها قابل تهیه است میتوانند استفاده شوند (آنطور که در متن مشخص شده است ) . سوم اینکه این اطلاعات برای محققینی مفید خواهد بود که در حال حاضر اندکی تجربه با این تکنیک دارند اما مشکلاتی در بدست آوردن و تحلیل داده ها دارند.
بیاد داشته باشید که کاربرد الایزا برای مشکلاتی خاص است و به خودی خود روش شناسی نیست ،یعنی اینکه مهمترین دلیل توجه به تکنیک ها همین است .
1
نمای آزمایش
شما اکنون با مفاهیم الایزا آشنا شدید که در آن یک انتی ژن به انتی بادی ای متصل میشود که با یک انزیم نشاندار شود و یا اینکه درعوض با یک انتی بادی اختصاصی ضد گونه(نشاندار با انزیم) تشخیص داده شود .تمام الایزا هایی که توصیف شده اند تغییراتی از این نمای کلی هستند . درهمه الایزا ها یکی از ریاجنتها به فاز جامد می چسبد و باعث جداسازی ساده ریاجنتهای متصل شده (واکنش داده) و متصل نشده (واکنش نداده ) با یک مرحله شستشومی شود.قبل از انجام الایزا روی عوامل بیماری بهتراست که کاربران در استفاده از ریاجنتها دارای واکنشگری معین آموزش ببینند که کدامیک به راحتی در دسترس است و کدامیک مشکلات امنیتی ایجاد میکند .یک سیستم ایده ال این است که از یک ایمونوگلوبولین (Ig) -به ویژه ایمونوگلوبولین G (IgG) - به عنوان انتی ژن استفاده کند.اشتباه نکنید همانطور که یاد گرفتید جمعیت انتی بادی دارای سطوح بالایی از IgG به عنوان انتی بادی است .دراصل ما از IgG به عنوان یک پروتیین انتی ژنی استفاده میکنیم چون 1) IgG از یک گونه حیوانی می تواند به یک گونه حیوانی دیگر تزریق شود تا انتی سرم اختصاصی ضد آن igg تولید شود و 2) چنین انتی بادی هایی را میتوان با انزیم نشاندار کرد ویا با یک انتی بادی دوم اختصاصی ضد گونه نشاندارشده با انزیم ،این آنتی بادیها را شناسایی کرد.
چنین ریاجنتهایی را میتوان تعریف کرد ،استاندارد سازی ،پایدار و از نظر تجاری در دسترس نمود.سیستم ویژه IgG انتخاب شده دراین فصل خوکچه هندی است اما ازمایشهای مشابه را می توان با IgG سایر گونه ها و استفاده از ریاجنتهای ضد گونه مناسب انجام داد . سیستم هایی که توصیف میشوند مشابه انواع معمول در بررسی مشکلات تشخیصی هستند .
طرحها بصورت نماد هایی توصیف میشوند وبه صورت ازمایشهای عملی کامل در ادامه می آیند:
I= یک چاهک پلیت میکروتیتر به عنوان فاز جامد Ag= آنتی ژن . I-Ag = آنتی ژنی که بصورت غیر فعال به فاز جامد چسبیده است I-AB ، I-Ab = آنتی بادی های ویژه ای که بصورت غیر فعال به چاهک ها چسبیده اند Ab = آنتی بادی AB= آنتی بادی از گونه ای متفاوت از گونه Ab . Abx , Aby = انتی بادی های مختلف که با یک حرف سومی از دیگری متمایز شده است . Anti-Ab= انتی بادی اختصاصی ضد گونه (گونه ای که Ab در آن ایجاد شده است ) . Anti-Ab*E= انتی بادی اختصاصی ضد گونه که با انزیم نشاندار شده است .
W= مرحله شستشو
+= اضافه کردن ریاجنتها و مرحله اینکوباسیون
S= اضافه کردن سوبسترا / رنگزا
R= خواندن ازمایش در اسپکتروفتومتر
بسیاری از مراحل عملی شبیه به هم هستند. کنژوگه استفاده شده هورس رادیش پراکسیداز (HRP) و سوبسترا / رنگزا H2O2 /ارتوفنیل اندیامین (OPD) است .جزییات عملی ذیل مفید میتواند باشد:
- سوبسترا / رنگزا . آسان ترین شیوه استفاده از قرص های است که از قبل توزین شده اند.همچنین قرص های سیترات /فسفات را میتوان خریداری کرد(pH=5.0).فراورده های تجاری از این سوبسترا / رنگزا وجود دارد که تنها به اضافه کردن آب نیاز دارند.من قرص های 30mg را توصیه میکنم که 75ml از محلول در بافر ایجاد میکنند.محلول OPD مصرف نشده ( بدون هیدروژن پراکساید اضافه شده) را می توان در -20 C درجه ذخیره کرد اما باید به دقت از نظر عدم رنگدهی در هنگام ذوب شدن بررسی گردد.محلول ساخته شده را هرچه زودتر استفاده کنید.تمام مایع ها باید در دمای مناسب باشند .هیدروژن پراکساید رامیتوان به صورت محلول 3 یا 6% خریداری کرد و باید همانطور که تامین کننده گفته است ذخیره گردند.قرص های اوره / پراکساید را نیز می توان تهیه کرد و ذخیره ای از هیدروژن پراکساید را با یک قدرت معین ساخت بجای اینکه بصورت مایع خریداری کرد که محدودیتهای حمل و نقلی دارد.هیدروژن پراکساید باید در غلظت مورد نیاز درست قبل از اضافه کردن به چاهک ها اضافه شود برای مثال 5 uL از هیدروژن پراکساید (30%w/v) را به هر 10 mL OPD محلول بیفزایید( در بافر سیترات فسفات با pH=5.0) یا 25uL از هیدروژن پراکساید 6% (w/v) .ضروری است که قدرت هیدروژن پراکساید صحیح باشد.
- محلول شستشو بافر نمکی فسفات (PBS) بدون اضافه کردن Tween-20 است .شستشوبا اضافه کردن و خالی کردن چاهکها برای چهار مرتبه انجام میشود.
- بافر مسدود کننده PBS است با غلظت نهایی 1% از البومین سرم گاوی (BSA) و 0.05% Tween-20.این محلول باید در حجم مورد نیاز ساخته شود اما می توان در 4 درجه به شرط آلوده نشدن ذخیره کرد و باید همیشه قبل از استفاده آنرا گرم کرد و از نظر الودگی بررسی نمود.
- محلول متوقف کننده اسید سولفوریک 1 مولار است و در تهیه آن باید دقت شود. این محلول را میتوان دردمای اتاق نگه داری کرد.
- خوانش یعنی استفاده از یک اسپکتروفتومتر چند کاناله است که تراکم نوری پلیت ها را ارزیابی میکند و در تمام موارد در این فصل 492nm است.پلیتها را باید با چشم بررسی کنید تا مشخص شود که ایا خطای فاحشی وجود دارد و اینکه نتایج منطقی هستند.
1.1
الایزای مستقیم
تیتراسیون انتی ژن و انتی بادی
1.1.1
یادگیری اصول
- اندازه گیری غلظت مناسب انتی ژن پوشاننده چاهکها
- اندازه گیری رقت مناسب انتی بادی متصل به انزیم
- استفاده از میکروپی پتهای چندکاناله و تک کاناله
- بازنگری اصول رقیق سازی
- ساختن و ذخیره سازی بافرها و محلولها
- یادیگیری بررسی ازمایش با چشم و با اسپکتروفتومتر چند کاناله
- مدیریت داده ها
- حل کردن مشکلات
1.1.2
نمای واکنش
I – Agw + Ab*Ew + S _ READ
که در آن I = چاهکهای میکروپلیت (فازجامد) ; Ag =IgG خوکچه هندی جذب شده به چاهکها است ; Ab*E= انتی بادی خرگوشی ضد انتی بادی خوکچه هندی است که با انزیم HRP کنژوگه شده است; S= H2O2 + OPD ; READ = بررسی با چشم یا خواندن با اسپکتروفتومتر است ( قبل یا بعد از متوقف کردن رنگ با H2SO4) ; + = اضافه کردن ریاجنت و اینکوباسیون در 37C یا دمای اتاق به مدت 1 ساعت است .; w = شستشوی چاهکها با PBS (چهار مرتبه ) .
1.1.3
پایه های سنجش
پایه این سنجش به این صورت است که انتی ژن را در پلیت دریک جهت در بافر رقیق کنید وبرای جذب غیر فعال پلیت را در 37 درجه یا دمای اتاق به مدت 2 ساعت اینکوبه کنید ، بعد پلیت را بشویید و آنگاه کنژوگه را در جهت مخالف با جهت رقیق سازی انتی ژن در سراسر پلیت رقیق کنید، تا یک تیتراسیون صفحه شطرنجی (CBT) از Agعلیه Ab* بدست اورید .Ab *E در بافری رقیق میشود که از جذب غیر اختصاصی Ab*E به مکانهای ازاد متصل شونده به پروتیین روی چاهکها جلوگیری میکند.بعد از شستشو به تمام چاهکها محلول سوبسترا برای انزیم (H2O2) و رنگزا که از اثر انزیم روی H2O2تغییر رنگ میدهد ، اضافه میشود.بنابراین رنگی که در هر چاهک ایجاد میشود بستگی دارد به 1) به مقدار انتی ژن و 2) مقدار کنژوگه که به انتی ژن متصل شده است .هر چه کنژوگه بیشتر باشد انزیم بیشتر است و رنگ بیشتری هم خواهد بود.
1.1.4
مواد و تجهیزات
- Ag : IgG خوکچه هندی در PBS با غلظت 1 mg/mL
- انتی بادی ضد IgG خوکچه هندی تهیه شده در خرگوش و کنژوگه شده با HRP
- میکروپلیت الایزا با 96 چاهک
- مبکروپی پت 12 کاناله ( 5 – 50 ul)
- میکروپی پت تک کاناله (5-50ul) به اضافه نوک ها و مخازن
- پی پتهای 10 و 1 میلی لیتر
- بافر کربنات/بی کربنات pH=9.5 , 0.05 M
- PBS دارای البومین سرم گاوی 10% (BSA) ، 0.05% Tween-20
- محلول OPD در بافر سیترات
- بطری هیدروژن پراکساید (30%w/v ، 4 درجه )
- مخزن محلول شستشو(PBS)
- سولفوریک اسید 1 مولار در آب
- دستمال کاغذی یا اسفنج نازک
- بطری های با حجم کم
- اسپکتروفتومتر چند کاناله
- ساعت
- کاغذ رسم نمودار
1.1.5
جزییات عملی
- پلیت را بررسی کنید ، جایگاه حروف را از A تا H و اعداد را از 1 تا 12 توجه کنید.پلیت را بصورتی که حرف A در بالا گوشه سمت چپ باشد مطابق شکل 1 قرار دهید.هشت چاهکی که با حروف (A-H) نشاندارد شده اند به عنوان ردیف خوانده میشوند . 12 چاهکی که با شماره ها (1 تا 12( نشاندار شده اند به عنوان ستون نامیده میشوند.
- با استفاده از پی پت 12 کاناله با 12 نوک 50ul از بافر کربنات به هر چاهک از پلیت اضافه کنید . ودر یک مخزن 6ml حجم اضافی از بافرمورد نیاز برای کل پلیت تهیه نمایید.
- انتی ژن (1 mg/mL) را در بافر کربنات با غلظت 10ug/mL رقیق کنید.1 mL از انتی ژن را با این غلظت تهیه نمایید.یعنی اینکه 1 ml از بافر را دریک بطری کوچک اضافه نمایید. 10 ul از انتی ژن را به این محلول اضافه نمایید.با چرخاندن بطری با دست، خوب آنرا مخلوط کنید (خیلی شدید تکان ندهید).
- یک میکروپی پت تک کاناله را روی 50ul تنظیم کنید. 50 ul از انتی ژن رقیق شده را به تمام چاهک ها درستون 1 بریزید.شما باید اکنون 100 ul از انتی ژن را در ستون 1 داشته باشید.
- نوک ها را در ستون 1 قرار دهید و محتویات را هشت بار با استفاده از گام اول پی پت پرو خالی نمایید تا مخلوط شوند.50 ul را به ستون 2 (A-H) منتقل کنید و مخلوط کنید و 50 ul به ستون 3 منتقل کنید و به همین ترتیب تا ستون 11 .بعد از مخلوط کردن آخر 50ul باقی مانده در پی پت را دور بریزید.شما باید اکنون 50ul از سری رقت را در هر ردیف که در ستون 11 تمام میشود داشته باشید.با چشم بررسی کنید که حجم ها در تمام چاهکها یکسان است(شکل 2 راببینید).
- یک برچسب روی پلیت قرار دهید و آنرا روی میز (سطح هموار) به مدت 2 ساعت دردمای اتاق یا د ر 37 درجه به مدت 2 ساعت و یا در 4 درجه به مدت یک شب قرار دهید.
- پلیت ها را شستشو دهید ، روش دقیقتر بستگی به تجهیزات دارد. اصل بر این است که محتویات چاهکها را با تکاندن آنها به داخل سینک ( یا یک ظرف مناسب ) خالی کنید آنگاه با اضافه کردن PBS و دور انداختن آنها و انجام این کار به تعداد چهار مرتبه شستشو را انجام دهید.توجه کنید که تمام چاهکها در هر مرحله کاملا پر میشوند.
- پلیت را روی یک کاغذ جاذب (اسفنجی ) برگردانید، و PBSباقی مانده را با تکاندن اهسته پلیت روی کاغذ حذف کنید (دهانه چاهک به سمت پایین باشد).
- برای اضافه کردن رقتهای کنژوگه ، کنژوگه انزیمی را از یخچال بردارید.بررسی کنید که ان انتی بادی ضد IgG خوکچه هندی درخرگوش تهیه شده و با HRP کنژوگه شده است(ممکن است گونه استفاده شده برای فراهم کردن انتی بادی نشاندار ضد سرم خوکچه هندی متفاوت باشد برای مثال می تواند انتی بادی گوسفندی ضد IgG خوکچه هندی باشد.).1 mL با رقت 1/200 از کنژوگه را در یک بطری 5mL تهیه کنید.از یک پی پت تک کاناله 5-50uL برای اضافه کردن کنژوگه استفاده کنید و 5uL از کنژوگه را به 1mL از بافر مسدود کننده اضافه کنید.( توجه کنید : ما نمی خواهیم که هیچ جذب غیر اختصاصی از کنژوگه به پلاستیک را طی ازمایش داشته باشیم).با چرخش آهسته مخلوط کردن را انجام دهید. این کار را با شدت انجام ندهید.50uL از بافر مسدود کننده را با استفاده از پی پت چند کاناله که با 12 نوک آماده شده است به تمام چاهکها اضافه کنید.این کار را می توان با اضافه کردن 6mL از بافر مسدود کننده در یک مخزن و پی پت کردن از آن انجام داد.بعد از توزیع بافر مسدود کننده با استفاده از شیر آب ( یاPBS) مخزن را بشویید.مخزن را برای استفاده از کنژوگه با یک دستمال کاغذی خشک کنید. کنژوگه رقیق شده را به داخل ظرف بریزید.با استفاده از پی پت چند کاناله با 12 نوک 50uL از رقت کنژوگه به داخل ردیف اول (A ، 1 تا 12) از پلیت بریزید.بنابراین 100uL از یک رقت 1/400 از کنژوگه در این ردیف وجود دارد.با استفاده از پی پت چند کاناله مخلوط کنید( هشت بار پر و خالی کنید).50uL از کنژوگه از ردیف A به B (1 تا 12) منتقل کنید و در ردیف B (هشت بار) مخلوط کنید.50uL به ردیف C (1 تا 12) منتقل کنید و مخلوط کنید.این انتقال رقت ها را تا انتهای پلیت (ردیف H) تکرار کنید.اکنون باید 50uL از رقتهای کنژوگه در تمام چاهکها با طیف رقتی شروع از 1/400 در ردیف A تا 1/51200 در ردیف H وجود داشته باشد.بصورت طرح در شکل 3 نشان داده شده است.بنابراین یک CBT در ارتباط با اینکه چگونه انتی ژن و انتی بادی رقیق میشوند انجام شده است.یک برچسب روی پلیت قرار داده و در دمای اتاق یا 37 درجه به مدت 1 ساعت باقی بگذارید.
- پلیت را بشویید و از محلول شستشوی اضافی پاک کنید(مرحله 7 را ببینید).
- برای اضافه کردن سوبسترا / رنگزا به منظور ایجاد رنگ 10 mL از بافر سیترات دارای OPD را در یک حمام آب گرم یا در دمای اتاق (آهسته تر) ذوب کنید یا محلول OPD را با استفاده از قرص های تجاری آماده بسازید.مطمین شوید که محلول به دمای قابل قبول رسیده باشد یعنی دمای اتاق، اگر این دما در ازمایشگاه شما ثابت است .نظر خوبی است که یک حمام آب در دمای 20 درجه داشته باشید تا محلول OPD را به دمای استاندارد برسانید.چون بر میزان رنگ در الایزا تاثیر دارد .5uL از هیدروژن پراکسید (30%) / 10mL OPD اضافه کنید.( بلافاصله به یخچال برگردانید و درب آنرا محکم ببندید).به اهستگی مخلوط کنید.محلول را به داخل یک ظرف بریزید( باید شسته شده و از هر گونه ریاجنت قبلی عاری باشد).از یک پی پت چند کاناله استفاده کنید و 50uL از محلول را به هر چاهک اضافه کنید (با 8 یا 12 نوک )
- پلیت را روی میز قرار داده و تغییر رنگ را در1 ،3 ،5 ،8 و 10 دقیقه بعد از اضافه کردن بررسی کنید.
- 50uL از محلول سولفوریک اسید 1 مولار در آب را بعد از 10 دقیقه از ایجاد رنگ به هر چاهک بیفزایید ( دوباره از یک ظرف تمیز و پی پت چند کاناله استفاده کنید) تا ایجاد رنگ را متوقف کنید.
- پلیت را با چشم و با یک اسپکتروفتومتر بخوانید
1.1.6
توضیح داده ها
شکل 4 نمای از پلیت در زمانهای متفاوت با استفاده از ریاجنتهای توصیف شده است قبل از اینکه پیشرفت رنگ متوقف شود .جدول 1 ارزیابی تشکیل رنگ را با چشم نشان میدهد.جدول 2 نتایج OD پلیت را که بعد از 10 دقیقه متوقف شده است نشان میدهد.این نتایج بصورت نموداری در شکل 5 تحلیل شده که ایجاد رنگ در چاهکها را با غلظتهای مختلف انتی ژن پوشش دهنده در برابر رقتهای مختلف کنژوگه ضد گونه ارتباط میدهد.
شکل 5 و جدول 2 رقت مناسب کنژوگه که میتوان در الایزا برای تشخیص IgG خوکچه هندی از آن استفاده کرد را نشان میدهد .همچنین غلظت انتی ژن مربوط که میتوان در تشخیص انتی بادی ها ( بیشتر مرتبط با الایزای غیر مستقیم است و در زیر عنوان 2 بطور کامل توضیح داده میشود) از آن استفاده کرد را می توان مشاهده نمود.این شکل ها به افرادی که هرگز الایزا ندیده اند نشان میدهد در الایزا منتظر چه چیزی باشند و نیز می توانند از آن به عنوان مقایسه با نتایج ازمایش هایشان استفاده کنند.همچنین برای کسانی که این متن ها را میخوانند و دسترسی به ریاجنت ها نیز ندارند نیز مفید است چون از طریق این مثالها بدون نیاز به طراحی یک سنجش واقعی میتوانند این تجربیات را بررسی کنند.افرادی که سنجشی را مطابق دستورالعمل های زیر عنوان 1.1 انجام داده اند،میتوانند مشاهدات خودشان را با آنچه که توضیح داده شده مقایسه کنند.
1.1.7
جنبه هایی از سنجش توصیف شده
طی 30 ثانیه تا 1 دقیقه اول بعد از اضافه کردن سوبسترا چیز زیادی اتفاق نمی افتد. سپس رنگ در چاهکهای 1 تا 3 از ردیف های A و B و احتمالا C تشخیص داده میشود . شدیدترین رنگ در چاهکهایی که دارای بالاترین غلظتهای انتی ژن است دیده میشود.تا 3 دقیقه الگوی نمایش داده شده باید مطابقت کرده و رنگ در ردیفهای C تا E قابل تشخیص باشد .بعد از 6 دقیقه رنگ قوی تری در ردیفهای A تا D وجود خواهد داشت ، و درکل یک کاهش رنگ تدریجی در رنگ به موازات رقیق شدن انتی ژن در پلیت دیده میشود.چاهکهایی که هیچ رنگی را نشان نمی دهند (هیچ انتی بادی قابل تشخیصی وجود ندارد) برای ردیفهای A ،B ،C،D،E،F و G ستونهای 10،9 ،8 ،6 ، 4 ،3 ،و تمام ردیفها به ترتیب میباشند.
در 10 دقیقه (زمان متوقف کردن ایجاد رنگ) تغییر کمی در الگو اتفاق میافتد اگرچه شدت رنگ افزایش یافته است.توجه کنید که در بیشترین غلظت کنژوگه ممکن است مقداری رنگ در چاهک کنترل منفی (12 که قویترین غلظت کنژوگه در آن وجود دارد) دیده شود.همچنین به تغییر رنگ هنگام اضافه کردن سولفوریک اسید (متوقف کننده ) توجه کنید.
1.1.8
داده های پلیت ریدر
اجازه دهید درباره عوامل زیر بحث کنیم
- ارتفاع پلاتو
- پس زمینه،جذب غیر اختصاصی کنژوگه
- پس زمینه پلیت
تغییر رنگ مربوط به هر یک از چاهکها اکنون مشخص شده است بطوری که وضعیت واقعی چاهکها مطابق شکل 6 قابل ارزیابی است.هر خط نمایانگر تیتراسیون رقت مختلفی از کنژوگه در برابر رقت یکسانی از انتی ژن است .توجه کنید که ردیفهای Aو B کاملا شبیه هم هستند.رنگ چاهکهای 1 و 2 بدون هیچ کاهشی در رنگ با فرض کاهشی بودن غلظت انتی ژن در پلیت ،شبیه به هم است.این نمایانگر ناحیه پلاتو است (رنگ بالای ثابت ).
بنابراین آنطور که ازتشکیل رنگ نتیجه گیری میشود چاهکهای پلیت مقدار مشابهی از انتی ژن داشته و به این معنی است که در سطوح انتی ژن بالاتراز چاهک 2 هیچ انتی ژن اضافی نمی تواند به پلاستیک چاهکها بچسبد و این به دلیل ظرفیت اتصال پلاستیک است و از پروتیینی به پروتیین دیگر فرق میکند.
از چاهک 3 به بعد در ردیفهای AوB رنگ کاهش مییابد و متناسب با رقت انتی ژن در چاهکها است.توجه کنید که از A10 تا A12 رنگ مشابهی وجود دارد(حدود 0.31( .این نمایانگر نقطه انتهایی تیتراسیون در رقت کنژوگه مربوط به 1/400 است.
اگر چه ردیف B یک طیف رقت مشابهی را نشان میدهد اما توجه کنید که رنگ در 10 تا 12 شبیه به همدیگربوده ولی از ردیف A پایین تر است .به ویژه در چاهک 12 در ردیف B توجه کنید.این چاهکی است که هیچ نوع انتی ژنی ندارد و رنگ تشکیل شده در این ردیف نمایانگر جذب غیر اختصاصی کنژوگه است.
رنگ در ستون 12 همانطور که کنژوگه رقیق میشود ( مانند C12=0.16) کاهش می یابد و سپس در یک سطح یکسانی باقی میماند.نتیجه این که رقتهای کنژوگه 1/400 و 1/800 سبب ایجاد مشکل در جذب غیر اختصاصی میگردد.پایین تر از این رقتها دیگر مشکلی وجود ندارد.مقدار رنگ باقی مانده مستقل از رقت کنژوگه است و پس زمینه پلیت محسوب شده و در نتیجه تغییر در رنگ سوبسترا ومستقل از هر گونه فعالیت انزیمی (اکسیداسیون بخاطر هوا ، اثر نور)می باشد.
ردیف C طیف تیتراسیون رنگی خوبی را نشان میدهد ( سطوح بالای رنگ درجایی که انتی ژن وجود دارد در برابر سطوح پایینی از رنگ هنگام رقیق شدن انتی ژن ).نقطه انتهایی تیتراسیون در حدود چاهک 9 است ( اخرین رقتی که نشاندهنده رنگی بالاتر از پس زمینه پلیت است )، که شبیه به ردیفهای A و B است ( از آنجایی که پس زمینه آنها بالاتر است ).
ردیف D نیز تیتراسیون خوبی از انتی ژن را نشان میدهد اگر چه رنگ آن ضعیف تراست و نقطه انتهایی در حدود چاهک 8 است.این نشان میدهد که ما مقداری حساسیت در تیتراسیون انتی ژن را از دست داده ایم .چاهکهای E تا G نشاندهنده از دست رفتن حساسیت با رقیق شدن کنژوگه است به ویژه در چاهک G که در آن هیچ تیتراسیون انتی ژن وجود ندارد.
1.1.9
رقتهای مناسب
اکنون میتوانیم تعیین کنیم که 1) رقت کنژوگه مورد استفاده در الایزا برای تشخیص IgG خوکچه هندی چقدر است و 2) چه رقتی از انتی ژن (IgG) می تواند در دیگر سنجش ها نیز در پلیت استفاده شود .به یاد داشته باشید که این ازمایش توصیف اصول مورد استفاده در سنجشهای انتی ژن اختصاصی است .همین ازمایش می تواند برای استاندارد سازی آنها نیز استفاده شود ( در زیر عنوان 2 بیشتر توضیح داده شده است ).
رقت مناسب کنژوگه
رقتهای 1/400 و 1/800 تیتراسیون خوبی با پس زمینه های بالا میدهد .1/1600 یک منحنی تیتراسیون مشابه با نقطه انتهایی مشابه با 1/400 و 1/800 اما با یک پس زمینه پایین تر میدهد.بنابراین میتوانیم این رقت را بدون از دست دادن حساسیت استفاده کنیم . همانطور که از محدود شدن نقطه انتهایی میتوان نتیجه گرفت1/3200 نیز تیتراسیون خوبی از انتی ژن را نشان میدهد اگر چه مقداری از حساسیت ( توانایی واکنش با انتی ژن )را از دست داده ایم .بنابراین رقت مناسب جایی بین 1/1600 و 1/3200 است .در عمل رقت 1/2000 برای ازمایشهای اولیه استفاده میشود . ممکن است این رقت در ازمایشهای بعدی با استفاده از انتی ژنهای ویژه اصلاح شود ( به عنوان مثال در سنجش برای تیتراسیون کنژوگه های ضد گونه که سپس در الایزای غیر مستقیم استفاده شود).
رقت مناسب انتی ژن
رقت مناسب انتی ژن با الایزاهای دیگر مرتبط است که در آن آنتی ژنهای اختصاصی لازم است قبل از استفاده تیتر شوند به عنوان مثال در الایزای غیر مستقیم . ممکن است دوست داشته باشیم از یک رقت ثابت IgG برای تشخیص انتی بادی علیه IgG خوکچه هندی استفاده کنیم .سطوح IgG موجود بعد از جذب در چاهکها در رنگ ایجاد شده انعکاس می یابد.در رقتهای بالا رنگ کمی وجود دارد و بنابراین IgG کمی چسبیده است .در ناحیه پلاتو ( در سطح اشباع پلاستیک ) IgG اصافی وجود دارد.مقدار مناسب برای تیتر کردن انتی بادی هنگامی است که 1 تا 1.5 واحد OD از رنگ با استفاده از رقت مناسب کنژوگه بدست میاید.بنابراین رقتهای انتی ژن در چاهکهای 3 و 4 برای واکنش با انتی بادی مناسب است .مقدار دقیق را میتوان بعد از ارزیابی واقعی در سنجشهای اختصاصی اصلاح کرد.
1.2
نتیجه گیری
الایزای مستقیم به این خاطر که محقق را با الایزا اشنا میکند بطور گسترده ای توصیف شده است.بسیاری از زمینه هایی که به آن پرداخته شده است نیاز به توضیح زیادی ندارد بنابراین دستورالعمل های نشان داده شده در الایزا جزییات کمی دارد.کاربرد عمده الایزای مستقیم به خاطر توانایی آن در تیتر کردن کنژوگه های ضد گونه است و بنابراین از استفاده از فراورده های خیلی قوی یا خیلی ضعیف پیشگیری میکند.بعضی از اصول اصلی الایزا معرفی شده اند ، ارتفاع پلاتو ،نقطه انتهایی،واکنشهای غیر اختصاصی ،پس زمینه ها ،و منحنی های تیتراسیون و این ها بطور مکرر در تمام سنجشها مرور خواهند شد.
2
الایزای غیر مستقیم
این بخش طراحی الایزا را با استفاده از مواد غیر پاتوژن توضیح میدهد.مناسب سازی الایزای غیر مستقیم توصیف میشود و به دنبال آن یک تمرین و کاربرد آن در تیتراسیون انتی بادی ها و سپس کاربرد آن در استفاده از رقتهای یکتا برای ارزیابی سرم ها .
2.1
یادگیری اصول
- اندازه گیری غلظت مناسب انتی ژن برای کوت کردن چاهکها
- تیترکردن انتی سرمها
- بکار گیری کنژوگه های ضد گونه
2.2
نمای واکنش
I – Agw + Abw + Anti-Ab*Ew + S _ Read
که I = چاهکهای میکروپلیت ; Ag = IgG خوکچه هندی است که به چاهکها چسبیده است ; Ab = سرم خرگوشی ضد خوکچه هندی ; Anti-Ab*E= سرم بز ضد سرم خرگوش که با HRP کنژوگه شده است ; S = H2O2+OPD ; READ= مشاهده با چشم یا خوانش با اسپکتروفتومتر; += اضافه کردن و اینکوباسیون در 37 درجه یا در دمای اتاق به مدت 1 ساعت ; W= شستشوی پلیتها با PBS است.
2.3
پایه سنجش
پایه این سنجش این است که انتی بادی هایی را که با یک انتی ژن واکنش داده با استفاده از یک کنژوگه ضد گونه تیتر کنیم.واژه غیر مستقیم به این حقیقت اشاره دارد که انتی سرم اختصاصی علیه انتی ژن ، نشاندار شده با انزیم نیست اما یک انتی بادی دوم اختصاصی ضد گونه ای که انتی بادی اول در آن تولید شده نشاندار میشود.چنین سنجشهایی انعطاف پذیر بوده و پایه ای برای دیگر الایزا ها میباشند.در اصل مناسب سازی ریاجنتها شبیه به الایزای مستقیم است .با این حال سه عامل باید در نظر گرفته شود.
- رقت مناسب انتی ژن
- رقتهای مناسب انتی سرم ها
- رقت مناسب کنژوگه
به فاکتور سوم در الایزای مستقیم پرداخته شد.شما الان باید قادر باشید که کنژوگه را تیتر کنید( در این مورد انتی بادی ضد خرگوش).کاربرد اصلی الایزای غیر مستقیم تیترکردن انتی بادی های ضد انتی ژنهای اختصاصی است.دراین مورد یک مقدار ثابت از انتی ژن به چاهکها جذب میشود و انتی سرم ها دربرابر آن به صورت طیف های رقتی تیتر میشوند.سپس هر گونه انتی بادی واکنش دهنده با اضافه کردن یک مقدار ثابت از کنژوگه ضد گونه تشخیص داده میشود.چنین سنجشهایی را میتوان بطور کامل از نقطه نظر تشخیصی و تعداد زمینه های کاری مربوط و انتی سرم های تجربی ( با تاریخچه معلوم ) ارزیابی کرد.بنابراین می توان با یک رقت انتی سرم ، سنجش را انجام داد و ازمایش ها را با استفاده از انتی سرمهای مثبت و منفی استاندارد کنترل نمود.بنابراین الایزای غیر مستقیم کاربردهای زیادی در مطالعات اپیدمیولوژیکی وارزیابی وضعیت بیماری پیدا کرده است.
2.4
مواد و ریاجنتها
- Ag : IgG خوکچه هندی با غلظت 1mg/mL(1g/l)
- Ab: سرم خرگوشی ضد خوکچه هندی
- انتی - انتی بادی نشاندار با انزیم : سرم گوسفندی ضد خرگوش متصل به HRP .
- میکروپلیت ها
- پی پتهای چند کاناله و تک کاناله
- پی پتهای 10 و 1 میلی لیتر
- بافر کربنات /بی کربنات با pH 9.6 , 0.05 M
- Pbs دارای BSA 10% و 0.05% Tween-20ُ
- محلول OPD در بافر سیترات
- یک بطری هیدروژن پراکسید (30%w/v) .
- محلول شستشو (PBS)
- سولفوریک اسید 1 M در آب
- حوله کاغذی
- بطری های با حجم کوچک
- اسپکتروفتومتر چند کاناله
- ساعت
- کاغذ رسم نمودار
2.5
روش انجام الایزای غیر مستقیم
اولین مرحله در این سنجش تیتراسیون کنژوگه ضد گونه با شرایط توصیف شده در الایزای مستقیم است. یاد داشته باشید که انتی ژن استفاده شده در تیتراسیون کنژوگه باید مرتبط باشد: برای مثال اگر یک کنژوگه ضد گاوی قرار است استفاده شود پس، از BSA به عنوان انتی ژن در CBT اولیه باید استفاده کرد.اگر تشخیص IgG ضد گاوی قرار است انجام شود پس IgG گاوی به عنوان انتی ژن در CBT الایزای مستقیم باید استفاده شود.
کنژوگه ضد خرگوش لازم است که تیتراسیون شود تا رقت مورد استفاده در سنجش غیر مستقیم را بدانیم و بتوانیم هر گونه سرم خرگوشی واکنش دهنده را شناسایی کنیم(رقت مناسب کنژوگه ممکن است به تفکیک کلاس وجود داشته باشد و یا اینکه از آزمایشهای پیشین به دست امده باشد)
- کنژوگه ضد خرگوشی را تیترکنید( رقت مناسب ممکن است وجود داشته باشد).
- یک میکروتیتر پلیت را بردارید و A1 در گوشه سمت چپ و بالا باشد. 50uL از بافر کربنات /بی کربنات را با استفاده از یک پی پت چند کاناله به هر چاهک بریزید.
- یک طیف رقتی از IgG خوکچه هندی با غلظت آغازین 5ug/mL از ستون 1 (هشت چاهک) تا 11 بسازید.این دقیقا همانند الایزای مستقیم است که توصیف شد . 50uL از IgG خوکچه هندی با غلظت 10ug/mL (یا 1/50 اگر غلظت معلوم نیست ) به ستون 1 اضافه کنید. مخلوط کنید( با استفاده از یک پی پت چند کاناله هشت مرتبه پر و خالی کنید) وسپس 5ouL از این رقت به ستون 2 اضافه کنید.مخلوط کنید و انتقال را ادامه دهید تا ستون 11 .50ul باقی مانده در نوکها را بعد از مخلوط کردن در ستون 11 دور بریزید.بنابراین یک طیف رقت دو برابری از IgG در هر ردیف از A تا H داریم به استثنای چاهکهای ستون 12 .
- در دمای اتاق یا 37 درجه به مدت 2 ساعت اینکوبه کنید
- با PBS چاهکها را بشویید ( چاهکها را چهار مرتبه پر و خالی کنید).
- پلیت ها را خشک کنید.
- سرم خرگوشی ضد خوکچه هندی را در بافر مسدود کننده(PBS حاوی 1% BSA و 0.05% Tween-20) 1/50 رقیق کنید. 1 mL تهیه کنید و بنابراین 20uL به 1mL بافر اضافه کنید.
- 50uL از بافرمسدود کننده به تمام چاهکها با استفاده از پی پت چندکاناله اضافه کنید.
- 50uL از سرم 1/50 ضد خوکچه هندی را به هر چاهک از ردیف A بریزید.مخلوط کنید و 50ul به ردیف B منتقل کنید ، مخلوط کنید و 50uL به ردیف C منتقل کنید و این روش را تا ردیف H تکرار کنید. اکنون یک سری رقت دو برابری از انتی بادی در جهت مخالف با انتی ژن IgG داریم.
- پلیت را در دمای اتاق یا 37 درجه به مدت 1 ساعت اینکوبه کنید.
- پلیت را بشویید و خشک کنید
- کنژوگه ضد گونه (در -20 درجه نگه دارید) را به رقت مناسب بدست آمده در الایزای مستقیم (یا طبق دستورسازنده)در باقر مسدود کننده رقیق کنید .برای تمام چاهکهای پلیت به اندازه کافی به همراه 0.5 ml اضافه بسازید(تقریبا 5.5 mL) .ممکن است این ضایع کردن به نظر برسد اما راحتی کار وقتی درک میشود که جبران کننده خطاهای کوچک است ونیاز به ساخت حجم کوچکی از کنژوگه را برای ردیف اخر، هنگامی که کنژوگه به اتمام میرسد برطرف میکند( در مقایسه با هنگامی که حجم دقیق برای پر کردن چاهکهای پلیت ساخته میشود ).50 uL از رقت را با استفاده از پی پت چند کاناله و ظرف تمیز به هر یک از چاهکها بریزید .
- در دمای اتاق یا 37 درجه به مدت 1 ساعت اینکوبه کنید
- چاهکها را بشویید و خشک کنید.
- OPD را کاملا ذوب کنید(10 mL) . 5uL از H2O2 را درست قبل از استفاده اضافه کنید.خوب مخلوط کنید.50 uL از این محلول را با استفاده از پی پت چندکاناله و ظرفهای تمیز به هریک از چاهکها بریزید( مطمین شوید که ظرف با کنژوگه های قبلی الوده نباشد).
- به مدت 10 دقیقه اینکوبه کنید(به تغییر رنگ توجه کنید)
- تشکیل رنگ را با اضافه کردن 50 uL از سولفوریک اسید1M به هر چاهک متوقف کنید
- پلیت را بعد از تیتراسیون انتی ژن (IgG خوکچه هندی ) و انتی بادی ( سرم ضد خوکچه هندی ) با چشم و با یک اسپکتروفتومتر چند کاناله بخوانید.
2.6
نتایج
جدول 3 نتایج میکروپلیت ریدر را نشان میدهد.توجه کنید که این نتایج تصویری شبیه به نتایج الایزای مستقیم را ارایه داده است .همچنین باید دیده باشید که در 10 دقیقه اینکوباسیون بعد از اضافه کردن محلول سوبسترا تشکیل رنگی مشابه وجود دارد.شکل 7 بطور نمودار داده ها را نشان میدهد.
نمودارهای مرتبط کننده غلظت ( یا رقت ) IgG (Ag) به OD ، برای تمام رقتهای مختلف سرم خرگوشی ضد IgG نشان داده شده است .
نمودار داده ها را که مرتبط کننده غلظت IgG بصورت لگاریتم سری دو برابری( ug/mL برای هر چاهک یا اگر غلظت واقعی معلوم نیست بصورت رقت ) است در برابر OD برای هر رقت از انتی بادی رسم کنید. شما باید هشت خط روی یک نمودار یکی برای هر رقت انتی سرم داشته باشید.شما اکنون نتایجی شبیه به الایزای مستقیم را مشاهده کرده اید .بخشهایی از واکنش مشابه را میتوان روی CBT غیرمستقیم شناسایی کرد.
- پلاتوهایی با رنگ بالای مشابه در ردیفهای A و B، چاهکهای 1 تا 4 دیده میشود.
- مقدارهای پس زمینه بالا در پلیت در ردیفهای A و B (احتمالاC) دیده میشود درمقایسه با رقتهای بیشتر سرم.
- نقاط انتهایی تیتراسیون سرم (جایی که مقدار OD غلظت IgG برابربا پس زمینه پلیت است)شبیه به ردیفهای A تا D است .بعد از این رقت از انتی سرم قدرت تشخیص IgG کاهش میابد .
- کاهش تشخیص نقطه انتهایی با از دست دادن OD درغلظتهای بالای IgG مرتبط است.برای مثال در ردیفهای F تا Hدر غلظت 5 ug/mL از IgG شاهد از دست رفتن اساسی و افزایش یابنده ای در رنگ در مقایسه با جایی که رنگ بیشینه(در مازاد انتی بادی : ردیف A) وجود دارد، هستیم . توجه کنید که ردیف H اصلا IgG را تیتر نمیکند ، رنگ خیلی کمی به دست آمده است .
2.6.1
مناسب سازی ریاجنتها
ردیفهای A و B مشخص می کنند که انتی بادی بصورت مازاد است و مقداری مشکل جذب غیر اختصاصی به پلیت داریم بدون اینکه انتی ژنی جذب شده باشد (چاهک 12).توجه کنید که در این ردیفها نواحی پلاتو به چاهکهای جلوترتوسعه می یابد.بنابراین انتی ژن بیشتری (IgG) بالاتر از غلظت موجود در چاهک 4 به پلیت جذب نمیشود.ردیفهای C و D تیتراسیونهای مناسبی از IgG را ارایه میدهند چون در آنها مقدار بیشینه OD از 1.6 تجاوز نمیکند و تیترهای بالایی از نقطه انتهایی حاصل میشود.پایین تر از این رقتها حساسیت برای تشخیص IgGاز دست میرود.بنابراین برای تشخیص انتی ژن بطور مناسب و برای استفاده از یک رقت انتی سرم با شرایط توصیف شده الایزا رقتی در حدود 1/400 تا 1/800 را استفاده کنید.
رقت مناسبی از انتی ژن که اگر به عنوان یک رقت منفرد برای تشخیص و اندازه گیری انتی بادی ها استفاده شود هنگامی به عنوان بهترین رقت (یا غلظت ) ارزیابی میشود که اتصال خوبی را در سراسر طیف رقتی انتی سرم نشان بدهد.بهترین راه برای نمایش دادن این مطلب کشیدن یک نمودار از داده های پلیت است اما این بار رقتهای سرم را در برابر OD غلظتهای مختلف انتی ژن ( یا رقتهای مختلف انتی ژن )رسم کنید.در شکل 7 این کار انجام شده است .
در چهار غلظت اول (رقت اول ) از انتی ژن (IgG) اختلاف کمی در تشخیص نقطه انتهایی به موازات کاهش رقت انتی سرم وجود دارد .بعد از این خوانشهای OD و تشخیص نقطه انتهایی کاهش می یابند .در بخشهای انتهایی در ستون 10 هیچ انتی بادی قابل تشخیص نیست حتی جایی که سرم بیشترین غلظت را دارد. مقدار بالای رنگ در ردیفهای A تا C در چاهکهای ردیف 12 با اتصال غیر اختصاصی مرتبط است.بنابراین رقت انتی ژن در ستونهای 3 و 4 برای تشخیص انتی بادی ها مناسب است.
3
استفاده از الایزای غیر مستقیم برای تیتراسیون انتی باد یها
ریاجنتهای مناسب سازی شده در زیر عنوان 2.4 را میتوان برای اندازه گیری انتی بادیهای ضد IgG خوکچه هندی استفاده کرد.
3.1
یادگیری اصول
- تیتراسیون انتی بادی ها با استفاده از سرم های مثبت در طیف کاملی از رقت.
- تعیین سطح انتی بادیهای منفی به عنوان کنترل سرم های غیر ایمن
- تکرار نمونه های ازمایش شده
3.2
نمای واکنش
I-Agw + Abw + anti_Ab*Ew + S _ READ
که I= میکروپلیت ; Ag = غلظت مناسب انتی ژن ; Ab= سرم ازمایش به اضافه یا منهای واکنش با Ag ; Anti-Ab*E= انتی بادی ضد گونه متصل به انزیم ; S = سیستم سوبسترا / تشخیص رنگ ; W = مرحله شستشو ; و + = اضافه کردن و اینکوباسیون واکنشگرها
در این تمرین Ag و Anti-Ab*E در رقت مناسب استفاده شده اند . انتی بادی های مورد ازمایش و یا انتی بادی های استاندارد به شکل طیفی از رقت اضافه میشوند.
3.3
پایه سنجش
ما اکنون میتوانیم انتی باد یها را تیتر کنیم چون رقتهای مناسب انتی ژن و کنژوگه را برای سیستم مفروض میدانیم. بنابراین اگر سرم ها با انتی ژن روی پلیت واکنش بدهند واگر دارای انتی بادی ضد IgG خوکچه هندی باشند با اضافه کردن کنژوگه شناسایی میشوند.سپس منحنی تیتراسیون سرم های مثبت با همدیگر و با منحنی سرمهای منفی مقایسه می شوند تا تیتر انتی بادی معین شود و نتایج واکنشهای غیر اختصاصی در رقتهای مختلف از سرمهای منفی در درون سیستم نیز بررسی میشوند.
3.4
مواد و ریاجنتها
- Ag : IgG خوکچه هندی با غلظت 1mg/mL
- Ab: سه نمونه سرم خرگوشی بعد از تزریق IgG خوکچه که در زمان های مختلف خونگیری شده اند و سه سرم خرگوشی از حیوانات انتی بادی منفی .
- Anti-Ab*E: سرم گوسفندی ضد خرگوش متصل شده به HRP
- میکروپلیتها
- پی پتهای چند کاناله یا تک کاناله
- پی پتهای 1 و 10 میلی لیتر
- بافر کربنات / بی کربنات با pH 9.6 , 0.05M .
- PBS دارای BSA 1% و 0.05% Tween-20
- محلول OPD
- پر اکسید هیدروژن
- محلول شستشو(PBS)
- سولفوریک اسید 1 M در آب
- حوله های کاغذی
- سیستم رقیق سازی و یا بطری های کم حجم
- اسپکتروفتومتر چند کاناله
- ساعت
- کاغذ رسم نمودار
3.5
تیتراسیون رقت یا غلظت انتی ژن برای اندازه گیری انتی بادی ها
تیتراسیون همانطوری است که برای الایزای غیر مستقیم گفته شد ( زیر عناوین 2.5 و 2.6 را ببینید) که در آن رقت مناسب کنژوگه را نیز تیتر کردیم .اکنون میخواهیم انتی بادی ضد IgG خوکچه هندی در سرمهای خرگوشی را تیتر کنیم.بنابراین یک CBT از IgG خوکچه هندی در برابر انتی سرم مثبت خرگوشی و با استفاده از یک رقت ثابت کنژوگه ضد خرگوشی انجام میدهیم.
توجه داشته باشید در طراحی الایزای غیر مستقیم یک سرم مثبت ضد انتی ژنی که قرار است تشخیص داده شود لازم است .چنین سرم هایی اغلب توسط دیگر سنجشهای سرولوژیکی معین شده و موجود هستند به عنوان مثال از سیستمهایی که انتی بادی های اختصاصی در آنها انتظار میرود (از حیوانات عفونی شده بصورت ازمایشگاهی یا واکسینه شده یا از حیواناتی که بطور ناگهانی عفونی شده اند). در شرایطی که سرم های زیادی در مقایسه با سرم های مثبت اولیه مورد بررسی قرار گیرند شرایط دقیق الایزا ممکن است طی مراحل طراحی تغییرکند. در حال حاضر شرایط مناسب با استفاده از سرم مثبت موجود ( تهیه شده به روش تجربی ) تعیین میشود.
3.6
تیتراسیون سرم های مختلف
- IgG خوکچه هندی (Ag) را به غلظت مناسب در بافر کربنات /بی کربنات ، pH 9.5 , 0.05M ( همانطورکه در زیر عنوان 2.1 گفته شد ) رقیق کنید.
- به هر چاهک از پلیت با استفاده از یک پی پت چند کاناله 50uL اضافه کنید
- به مدت 2 ساعت در 37 درجه اینکوبه کنید
- پلیت را بشویید و خشک کنید
- به تمام چاهکها با استفاده از یک پی پت چند کاناله و ظرف مخصوص 50uL از بافر مسدود کننده اضافه کنید.
- 6 سرم آماده شده را بردارید.سه سرم مثبت را با شماره های 1،2،3 شماره گذاری کنید.و سه سرم منفی را 4،5،6 شماره گذاری کنید.هر یک را به نسبت 1/20 در بافر مسدود کننده در ظرفهای کوچک رقیق کنید و یک حجم نهایی 0.5mL از هر یک تهیه کنید( 25uL + 475uL از بافر مسدود کننده ).
- پلیت را که 50uL از بافر مسدود کننده در هر چاهک دارد بچرخانید طوری که چاهک H1 گوشه بالا سمت چپ باشد(شکل 8 را ببینید).50 uL از رقت سرم 1 به چاهکهای H1 و H2 و 50 uL از رقت سرم 2 را به چاهکهای H3 و H4 و 50 uL از رقت سرم 3 را به چاهکهای H5 و H6 بریزید.این فرایند اضافه کردن را در مورد سرمهای 4 و 5 و 6 به چاهکهای H7 و H8 و H9 و H10 و H11 و H12 بریزید.اکنون هر یک از سرم ها را بصورت رقیق شده به نسبت 1/40 در 100ul از بافر مسدود کننده داریم که در انتهای سمت چپ ردیف H از پلیت واقع شده است (شکل 9 را ببینید).
- با استفاده از یک پی پت چند کاناله با 12 نوک مخلوط کنید و سرم ها را در چاهکهای G ،F ، E ،D ،C ،B و A با انتقال 50 uL از هر رقت ، رقیق سازی را انجام دهید. اکنون یک طیف رقتی دو برابری از سرم ها بصورت داپلیکیت داریم یعنی دو سری رقت از هر یک از سرمها وجود دارد ( شکل 9 را ببینید).
- در 37 درجه یا دمای اتاق به مدت 1 ساعت اینکوبه کنید ( شرایط دقیقی که در CBT الایزای غیر مستقیم استفاده کرده اید بهترین شرایط است ).
- پلیت را بشویید و خشک کنید
- 50uL از کنژوگه ضد خرگوشی را به هر چاهک اضافه کنید ( رقیق شده در بافر مسدود کننده )
- در 37 درجه ( یا دمای اتاق) به مدت 1 ساعت ( شرایطی همانند 1 ساعت اینکوباسیون درCBT) اینکوبه کنید.
- پلیت را بشویید و خشک کنید.
- سوبسترا و رنگزا را اضافه کنید (50uL) .
- بعد از 10 دقیقه تشکیل رنگ را متوقف کنید
- پلیت را در یک اسپکتروفتومتر چند کاناله بخوانید . توجه کنید که پلیت را در حین تشکیل رنگ نگاه کنید و یادداشت برداری نمایید.
3.7
توضیح دادها
شکل 10 نتایج این سنجش را نشان میدهد و جدول 4 خوانده های OD را ارایه میدهد.
- سرم 1: ارزش عددی نمونه های داپلیکیت کاملا شبیه به هم است . تیتراسیون ناحیه پلاتویی را نشان می دهد که مقدارها در آن یکسان است (چاهکهای H1 و H2 و چاهکهای G1 و G2 ).بنابراین رنگ بیشینه ای حداکثر تا 1/80 بدست آمده است ، افزایش در غلظت انتی بادی ها هیچ اثری روی خوانش ها ندارد.اینجا ناحیه ای است که تمام انتی ژن با انتی بادی اشباع شده است .مقدار OD وابسته به مقدار انتی ژنی است که به چاهکها چسبیده است و آن نیز خود وابسته به خصوصیات جذبی پلاستیک و غلظت انتی ژن است .با رقت بیشتر ،انتی بادی ها دیگر مازاد نبوده پس تیتر میشوند که با کاهش تدریجی در OD مشخص میشود.
- سرم 2: سطح OD حتی در 1/40 یکسان با انتی بادی سرم 1 در حالت مازاد، نیست .بنابراین انتی بادی ها انتی ژنها چسبیده به چاهکها را اشباع نکرده و بنابراین بصورت مازاد نمی باشند .تیتراسیون سرم بلافاصله به محض رقیق شدن، شروع میشود .توجه کنید که اخرین رقتها مقدار OD پایینی داده است که برخلاف سرم 1 هم ارز با پس زمینه پلیت است.
- سرم 3 : حتی در رقت 1/40 مقدارهای OD در مقایسه با نمونه های سرمی 1 و 2 پایین است.آنتی بادی های کمتری در این سرم نسبت به دوتای دیگر است و بازهم تیتراسیون بی درنگ با رقیق شدن شروع میشود و OD پایین (در حدود 0.19) در رقت 1/1280 بدست می آید.بطور کلی این سه سرم مثبت واکنشگری های مختلفی را از نظر مقدار آنتی بادی تیتر شده دارند.بنابراین سرم 1 بیشترین تیتر را داراست و یک پلاتو ( توانایی اشباع آنتی ژن را دارد) را نشان میدهد.سرم 2 بیشترین مقداربعدی از آنتی بادی را دارد چون نقطه انتهایی در حدود 1/5120 (نقطه ای که مقدار OD برابر با پس زمینه پلیت است) دارد.سرم 3 کمترین مقدار آنتی بادی را داراست و دارای یک نقطه انتهایی در حدود 1/1280.
- این سرم از نظر بالینی منفی است.بنابراین طبق تعریف باید هیچ آنتی بادی در آن وجود نداشته باشد.رنگی که بدست می آید بازگو کننده اتصال های غیر اختصاصی سرم به آنتی ژن است.بیشترین اتصال های غیر اختصاصی باید در کمترین رقت های نمونه درنظر گرفته شوند همانطور که در این مورد وجود دارد با پس زمینه ای در رقتهای 1/40 و 1/80 از رقتهای سرمی .توجه داشته باشید که سطح رنگ غیر اختصاصی خیلی از رنگ سرم های مثبت پایین تر بوده اما نسبت به رنگ پس زمینه پلیت بسیار مشخص تر است که میتوان آن را بجای پس زمینه دیده شده برای سرم های منفی در بالاترین رقت هایشان در نظر گرفت.توجه کنید که این چاهک ها (E,D,C,B,A) نتیجه های همانندی ارایه داده و تیتراسیون در برابر رقیق سازی دیده نمیشود.
-
سرم های 5 و 6 : این سرم ها نتایج مشابهی با سرم 4 دارند اگر چه مقدار کمی رنگ در چاهک 1/80 وجود دارد که بازگو کننده مقدار متفاوتی از اتصال غیراختصاصی پروتیین های سرم است.
- . شکلهای منحنی
داده های رسم شده به ویژه برای سرم های مثبت به جای خط های مستقیم ، خطهای منحنی میسازند.بطور کلی بخشی در منحنی وجود دارد که دارای سه تا پنج نقطه است که نسبت به دیگر نقطه ها بیشتر خطی است.بخش های غیرخطی در بالا و پایین نمودار رخ میدهند و چنین منحنی های سیگموییدی در تیتراسیون های سرمی همانطور که در شکل 11 نشان داده شده است طبیعی است.به دست آوردن دقیق نقطه انتهایی دشوار است.
3.7.2.مقایسه منحنی تیتراسیون سرمی
مقدار آنتی بادی اختصاصی در هر سرم در یک گستره رقتی تیتر گردید.سرم هایی که دارای بیشترین آنتی بادی هستند نقطه انتهایی( رقتی که میزان OD یکسان با OD پس زمینه است) با رقت بسیار بالا دارند.بنابراین همانطور که هم اکنون مشخص گردید نقطه های انتهایی را میتوان به عنوان نمایانگر تیتر سرمی با یکدیگر مقایسه کرد.این تیتر را میتوان هم به وسیله چشم و هم به وسیله دستگاه ارزیابی کرد.
یک برآورد خوب از نقطه پایانی را میتوان با کشیدن یک خط راست از نقطه های روی منحنی که تقریبا روی یک خط مستقیم هستند بدست آورد.اگر بصورت آماری این کار انجام شود یک آنالیز رگرسیون از نقطه ها انجام شده و بهترین خط از نظر ریاضی جور میشود (شکل 12 را ببینید).این برآورد از نظر نموداری با صحت خوبی نیز میتواند انجام شود).بنابراین نقطه های پایانی هنگامی که خط های رگرسیون ( یا خطهای درست شده روی نمودار) خط OD پس زمینه اندازه گیری شده را قطع میکنند ارزیابی میشوند با این فرض که منحنی ها دارای شکل یکسانی ( پس در این صورت خط ها موازی هستند ) هستند.
با این حال همیشه ممکن است این طور نباشد چرا که جمعیت های مختلف آنتی بادی ممکن است مسوول ایجاد رنگ در الایزا باشند.در این مورد اختلاف ها باید مورد توجه قرار گرفته و موضوع تیترهای دیده شده نیز باید در نظر گرفته شوند.توجه کنید که منحنی های بدست آمده برای سرم های منفی بسیار هموار هستند حتی در این صورت هم آنها دارای یک نقطه پایانی میباشند.سرم ها ممکن است تفاوت هایی در ارتفاع و شکل پلاتوی بیشینه داشته باشند(شکل 13).
شکل 14 تلاش میکند تا روشن کند چرا تفاوتهایی در ارتفاع پلاتو در سرم های مختلف وجود دارد.در اینجا چند سرم بصورت بیشینه ای با انتی ژن واکنش میدهند طوری که هیچ افزایشی در رنگ هنگامی که غلظت آنها افزایش می یابد ، دیده نمیشود. ارتفاع های پلاتو متفاوت است با این حال نشان میدهد که مقدارهای مختلفی از آنتی بادی با یک آنتی ژن یکسان واکنش داده اند.این واکنش تابعی از شمار مکان های آنتی ژنی واکنش دهنده روی آنتی ژن و مقدار و اختصاصیت جمعیت های آنتی بادی سرم ها است.اگر چه این رفتار به هنگام استفاده از آنتی بادی های پلی کلونال نامعمول است اما هنگام استفاده از آنتی بادی های منوکلونال معمول می باشد.
جایی که منحنی ها موازی هستند،هر نقطه ای روی آن را میتوان برای مقایسه نمونه ها بکار گرفت.این در شکل 15 نشان داده شده است.آنالیز هر چقدر سرم که ممکن باشد آنهم در یک سری رقتی کامل و ارزیابی آنها باید انجام شود تا معلوم گردد که آیا همسویی وجود دارد یا نه.این موضوع به ویژه هنگام آزمایش های تک نقطه (spot tests) ای مهم است چون یک رقت از نمونه آزمایش بکار برده میشود.رقتی بکار گرفته میشود که نمونه ها نتایج را در ناحیه های موازی از منحنی ارایه میدهند.
یک خط به یک OD ویژه کشیده میشود و رقتی از سرم که چنین OD میدهد برای همه سرم ها تعیین میشود و بنابراین تیتر مربوط معلوم میگردد.چنین تیترهای مربوط را میتوان با یک سرم استاندارد پذیرفته شده مقایسه کرد و به این صورت آنرا با هر واحدی بیان کرد.فعالیت واقعی سرم استاندارد ممکن است معلوم باشد ( مانند میلی لیتر/ میکروگرم از یک آنتی بادی خاص) و به این صورت همه سرم ها با این سرم استاندارد با یک واحد یکسان بیان میشوند.
3.7.3.سرم های منفی و سرم های کنترل
آزمایش در حال بررسی شامل یک کنترل است که از سرم های منفی گرفته میشود.بسیار خوب است که یک پس زمینه از پلیت گرفته شده تا رنگ در چاهکهای دارای تنها آنتی ژن و کنژوگه مشخص گردد.این مقدار باید همخوان با خوانده های تیتراسیون آنتی بادی ها حتی در صورت یک پلاتوی پایین و رقت نمونه ها باشد.چنین پس زمینه ای را میتوان از نتیجه های کل پلیت کم کرد پیش از اینکه داده ها را پردازش کرد و یا میتوان آن را پیش از خوانش با اسپکتروفتومتر، بلانک کرد.بکارگیری نتیجه های سرم منفی بستگی به این دارد که چه چیزهایی درباره منفی بودن این سرم ها معلوم است مانند نتایج دیگر آزمایش ها در باره این سرم های منفی و یافته های بالینی دیگر.برای نمونه گاو بریتانیایی به عنوان سرم منفی در مطالعه انتی سرم های ضد ویروس بیماری پا و دهان (FMDV=foot and mouth disease virus) بسیارخوب است چون بریتانیا از این بیماری عاری است .این موضوع ممکن است همیشه امکان پذیر نباشد به ویژه در کشورهایی که بیماری اندمیک است.نیز توجه کنید که سرم های منفی کنترل بدست آمده از دیگر کشورها از آنجایی که تفاوت ها و پیچیدگی ها بخاطر عفونتهای دیگر وجود دارد بازگو کننده همان جمعیت سرمی منفی آن کشور نیست.این سبب میشود که بر کارایی کیت ها که سرم های منفی استاندارد در آنها به عنوان کنترل بکار میرود اثر بگذارد.کیت ها باید هر جایی که ممکن باشد و در هر کشوری که از آن استفاده میشود ارزیابی شوند.ارزش کنترل برای سرم منفی تامین شده ممکن است بازگو کننده ارزش میانگین برای سرم های منفی نباشد.
3.7.4.انتخاب یک رقت سرمی تک برای انجام آزمایش نقطه ای
بررسی منحنی های سرمی تیتراسیون برای سرم های مثبت و منفی میتواند به ما بگوید که کدام رقت ممکن است درالایزای غیر مستقیم مناسب باشد تا آنتی بادی ها را بتوان با یک چاهک ( یا در چندین چاهک با رقتهای یکسان ) سنجش کرد.در شکل 10 ما می بینیم که فعالیت غیر اختصاصی پایین در سرم های منفی در رقتهای 1/40 و 1/80 دیده میشود.با این حال سرم های مثبت مقدارهای OD بالایی را در این رقتها نشان میدهند و بنابراین به حساسیت مربوط سنجش ( آشکارسازی آنتی بادی های اختصاصی ) میتوان در چنین رقتهایی دست یافت. با این حال اگر رقتهای بالاتر از 1/80 استفاده شود ما هنوز میتوانیم آنتی بادی را در غیاب واکنشهای غیر اختصاصی اندازه بگیریم.با این حال حساسیت افت میکند.به یاد داشته باشید که ما تلاش میکنیم تا میان حساسیت و پس زمینه پایین در حضور دیگر پروتیین های سرم در نمونه تعادل برقرار کنیم.اگر ما سرم ها را در رقت 1/160 استفاده کرده بودیم آنگاه مقدارهایی که برای الایزا میداشتیم همانطوری است که در جدول 5 نشان داده شده است.
بنابراین ارزش سرم های منفی در حدود 0.15 خواهد بود در حالی که سرم های مثبت بالای این مقدار است.آزمایش بعدی این شیوه را گسترش داده است.
-
استفاده از الایزای غیرمستقیم برای تعیین مثبت بودن سرم ها در یک رقت تک
- آموختن پایه ها
- بررسی جمعیت سرمی منفی برای تعیین مرزهای منفی بودن .
- بررسی جمعیت سرمی آنتی بادی مثبت.
- بررسی فراوانی نتیجه ها در یک جمعیت
-
نمای واکنش

که در آن I = میکروپلیت است ، Ag = غلظت مناسب آنتی ژن است ،Ab = سرم های آزمایش در یک رقت تک ، Anti-Ab*E = آنتی بادی ضد گونه است که به آنزیم متصل است ،S= سیستم آشکارسازی رنگ و سوبسترا است.
در این بررسی Ag و Anti-Ab*E در رقتهای مناسب استفاده میشوند.سرمهای آزمایش در یک رقت ثابت افزوده میشوند.آنتی سرمهای مثبت کنترل را میتوان در یک رقت ثابت یا بصورت یک گستره رقتی افزود تا یک منحنی استاندارد ساخت که رنگ را به رقت یا غلظت آنتی بادی های افزوده شده ارتباط میدهد.بنابراین سرم های آزمایش را میتوان به منحنی تیتراسیون سرم مثبت مرتبط کرد.همین کار را میتوان با شامل کردن استانداردهای سرم کنترل منفی پذیرفته شده انجام داد.
مواد و ریاجنت ها
Ag.1: IgG خوکچه هندی (1mg/mL) (یا از پیش تیتر شده)
Ab.2: 48 سرم خرگوشی با تیترهای بالا ،متوسط و پایین ضد IgG خوکچه هندی (24) و سرم های منفی (24).
Anti-Ab*E.3 : سرم گوسفندی ضد خرگوشی متصل به HRP .
.4میکروپلیتها
.5پی پتهای یک و چند کاناله
.6پی پتهای 10 و 1 میلی لیتر
.7بافر کربنات / بی کربنات
PBS.8 دارای BSA 1% و Tween-20 0.05% .
.9محلول OPD
.10پراکسید هیدروژن
.11محلول شستشو
.12حوله کاغذی
.13سولفوریک اسید 1 M در آب
.14تجهیزهای رقیق سازی در حجم های میکرونی و بطریها با حجم های کوچک
.15اسپکتروفتومتر چندکاناله
.16ساعت
.17کاغذ رسم نمودار
.18ماشین حساب
- روش آزمایش نقطه ای
از آزمایش های پیشین شما باید به رقتی از سرم آزمایش دست یافته باشید که میتوان برای جداسازی نتایج مثبت و نتایج غیراختصاصی منفی از آن استفاده کرد، سرمهای مثبت ومنفی گزینش شده برپایه تفاوتهای پیشتر صحبت شده و تیتراسیون آنها دریک گستره رقتی کامل مشخص گردیده اند.ما اکنون میخواهیم همه سرم ها را در رقتی که به آن دست یافتیم بصورت دوتایی ( دو چاهک برای یک رقت سرمی در الایزای غیرمستقیم) تیتر کنیم.
- IgG خوکچه هندی را به همه چاهکهای یک پلیت میکروتیتر در رقت مناسب بیفزاییید (همانند آزمایش های پیشین) و در 37 درجه به مدت 2 ساعت (یا در شرایط مناسب خاص ) همدما کنید.
- پلیت را شسته و خشک کنید.
جدول 6 نتیجه ها را نشان میدهد.نتیجه های بدست آمده در سنجشی که شما انجام دادید به همان روش میتوان پردازش کرد.شکل 17 یک نمایش طرحوار از پلیت متوقف شده است.
- نمونه های سرمی را بشکل مناسب در یک بافر مسدود کننده رقیق کنید.سرم ها را میتوان در بطری های با حجم کوچک رقیق کرد.با این حال این کار دو مشکل ایجاد میکند: کار با دست بسیار پر زحمت است و انتقال سرم های رقیق شده باید با یک پی پت تک کاناله انجام شود.مشکل اخیر مهم است چون انتقال همه سرم ها به چاهکهای مختلف زمان زیادی طول میکشد.نمونه هایی که زودتر افزوده شده اند زمان تماس بیشتری با آنتی ژن داشته اند و همین بر نتایج اثر میگذارد.از این مشکل میتوان با انتقال نمونه ها به دیگر پلیتها پیش از رقیق سازی (به عنوان مثال پلیتهای میکروتیتر پلاستیکی غیرالایزا در حجم هایی که صحت آنها اهمیت ندارد) پیشگیری کرد.سپس از این پلیت میتوان با استفاده از یک پی پت چندکاناله در صورتی که فاکتور رقت برای سرم ها زیاد بالا نباشد نمونه برداری کرد.رقتهای آغازین را میتوان بطور مستقیم بعنوان مثال در 100 ul بافر مسدود کننده در پلیتهای غیرالایزا رقیق کرد.انتقال حجم لازم ازنمونه آزمایش رقیق شده را میتوان با یک پی پت چند کاناله انجام داد.بنابراین نمونه ها تقریبا همزمان منتقل میشوند.سیستم های ویژه ای در کنار استفاده از پی پتهای چند کاناله ساخته شده است.این ها برای رقت سازی و نگه داری نمونه های آزمایش مناسب هستند.حجم هایی نزدیک به 1mL را میتوان به آسانی ساخت ،رقت های درستی تا 1/200 ( 5uL از نمونه در 1mL).سیستم رقیق سازی میکروتیتر باید برای چنین آزمایشی باید در دسترس باشد.
-
یک حجم از بافر مسدود کننده به لوله های پلاستیکی نگه داشته شده در نگه دارنده لوله بیفزایید.برای مثال اگر یک رقت 1/100 لازم باشد، 0.5 mL از بافر مسدود کننده را به هر لوله بیفزایید و سپس 5uL از نمونه آزماش را( شکل 16 را به عنوان الگوی نمونه ها در یک پلیت ببینید).به مدت 1 ساعت همانند آزمایش پیشین همدما کرده و همان گام ها را برای شستشو و رقت سازی ریاجنتها تا مرحله توقف دنبال کنید.مقدارهای OD را بخوانید.
-
نمونه داده ها
- روش آزمایش نقطه ای
از آزمایش های پیشین شما باید به رقتی از سرم آزمایش دست یافته باشید که میتوان برای جداسازی نتایج مثبت و نتایج غیراختصاصی منفی از آن استفاده کرد، سرمهای مثبت ومنفی گزینش شده برپایه تفاوتهای پیشتر صحبت شده و تیتراسیون آنها دریک گستره رقتی کامل مشخص گردیده اند.ما اکنون میخواهیم همه سرم ها را در رقتی که به آن دست یافتیم بصورت دوتایی ( دو چاهک برای یک رقت سرمی در الایزای غیرمستقیم) تیتر کنیم.
- IgG خوکچه هندی را به همه چاهکهای یک پلیت میکروتیتر در رقت مناسب بیفزاییید (همانند آزمایش های پیشین) و در 37 درجه به مدت 2 ساعت (یا در شرایط مناسب خاص ) همدما کنید.
- پلیت را شسته و خشک کنید.
- نمونه های سرمی را بشکل مناسب در یک بافر مسدود کننده رقیق کنید.سرم ها را میتوان در بطری های با حجم کوچک رقیق کرد.با این حال این کار دو مشکل ایجاد میکند: کار با دست بسیار پر زحمت است و انتقال سرم های رقیق شده باید با یک پی پت تک کاناله انجام شود.مشکل اخیر مهم است چون انتقال همه سرم ها به چاهکهای مختلف زمان زیادی طول میکشد.نمونه هایی که زودتر افزوده شده اند زمان تماس بیشتری با آنتی ژن داشته اند و همین بر نتایج اثر میگذارد.از این مشکل میتوان با انتقال نمونه ها به دیگر پلیتها پیش از رقیق سازی (به عنوان مثال پلیتهای میکروتیتر پلاستیکی غیرالایزا در حجم هایی که صحت آنها اهمیت ندارد) پیشگیری کرد.سپس از این پلیت میتوان با استفاده از یک پی پت چندکاناله در صورتی که فاکتور رقت برای سرم ها زیاد بالا نباشد نمونه برداری کرد.رقتهای آغازین را میتوان بطور مستقیم بعنوان مثال در 100 ul بافر مسدود کننده در پلیتهای غیرالایزا رقیق کرد.انتقال حجم لازم ازنمونه آزمایش رقیق شده را میتوان با یک پی پت چند کاناله انجام داد.بنابراین نمونه ها تقریبا همزمان منتقل میشوند.سیستم های ویژه ای در کنار استفاده از پی پتهای چند کاناله ساخته شده است.این ها برای رقت سازی و نگه داری نمونه های آزمایش مناسب هستند.حجم هایی نزدیک به 1mL را میتوان به آسانی ساخت ،رقت های درستی تا 1/200 ( 5uL از نمونه در 1mL).سیستم رقیق سازی میکروتیتر باید برای چنین آزمایشی باید در دسترس باشد.
-
یک حجم از بافر مسدود کننده به لوله های پلاستیکی نگه داشته شده در نگه دارنده لوله بیفزایید.برای مثال اگر یک رقت 1/100 لازم باشد، 0.5 mL از بافر مسدود کننده را به هر لوله بیفزایید و سپس 5uL از نمونه آزماش را( شکل 16 را به عنوان الگوی نمونه ها در یک پلیت ببینید).به مدت 1 ساعت همانند آزمایش پیشین همدما کرده و همان گام ها را برای شستشو و رقت سازی ریاجنتها تا مرحله توقف دنبال کنید.مقدارهای OD را بخوانید.
- نمونه داده ها
جدول 6 نتیجه ها را نشان میدهد.نتیجه های بدست آمده در سنجشی که شما انجام دادید به همان روش میتوان پردازش کرد.شکل 17 یک نمایش طرحوار از پلیت متوقف شده است.

-
نمونه داده ها
-
نمای واکنش
از آنجایی که به صورت آزمایش بصورت دوتایی انجام شده است اختلاف بین نمونه ها را بررسی کنید.این اختلاف نباید زیاد بالا باشد به عبارت دیگر باید اختلاف کمی بین OD های هر دو چاهک آزمایش از یک نمونه باشد.میانگین OD هر دو چاهک را اگر اختلاف زیاد بزرگ نباشد بدست آورید.اختلاف در نتیجه ها را میتوان در پایان بحث کرد.مقدار میانگین را تا دو رقم اعشار بدست آورید.
- میانگین و انحراف معیار میانگین داده های سرم منفی
همه میانگینهای سرم های منفی و همه میانگین و انحراف معیار جمعیت سرم منفی را با یک ماشین حساب بدست آورید.
- نمودارهای فراوانی نتایج OD سرم منفی
-
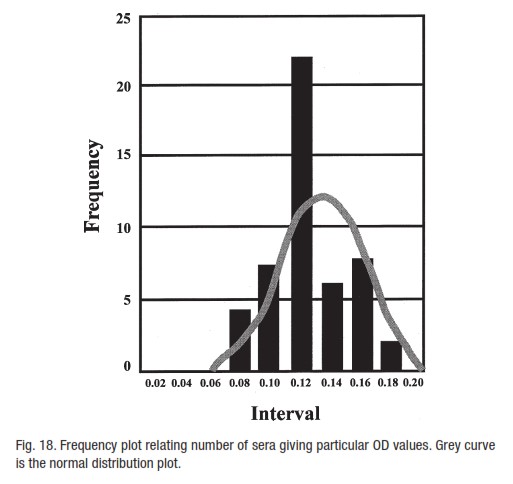
نتایج سرم منفی را همانند شکل 18 رسم کنید.این نمودار شمار نمونه هایی که یک OD ویژه میدهند را به هم وصل میکند.
توزیع فراوانی برای این بدست می آید تا توزیع نتایج منفی بدست آید.جدولی از فاصله های OD را بسازید و شمار سرم هایی را که در هر یک از این فاصله ها می افتند را یادداشت کنید.در نمودار شماره ها را در برابر فاصله ها رسم کنید.میانگین داده ها برای سرم منفی و SD داده ها را میتوان با یک ماشین حساب بدست آورد.به این ترتیب میانگینی از جمعیت سرم منفی در این مورد یافت میشود.اگر جمعیت خوانده های منفی الایزا بطور نرمال ( توزیع نرمال آماری ) توزیع شده باشد آنگاه مرز بالای منفی بودن را میتوان با حد اطمینان تعریف شده بسته به شمار SD های بکار رفته از میانگین تعیین نمود.
مقدار میانگین در این مورد 0.125 است و SD 0.026 میباشد.بنابراین اگر ما 3SD بالای مقدار میانگین (=0.084) را انتخاب کنیم و این مقدار را به میانگین بیفزایییم (=0.209) مقدارهای برابر ویا بالای این مقدار بعید خواهد بود که بخشی از جمعیت سرمی منفی اندازه گیری شده باشد چون ناشی از این حقیقت است که تنها 0.1% از سرم های منفی آزمایش شده به سوی این مقدار میل میکنند.استفاده از مرزهای 2SD بالای جمعیت منفی اندازه گیری شده به این معنی است که اطمینان به نتایج مثبت کاهش یافته است (حساسیت احتمالی افزایش یافته ولی اختصاصیت کاهش یافته است).
در عمل چنین توزیع هایی به سمت راست کج میشوند و بنابراین یک دنباله از نتایج درOD های بالاتر دیده میشود (شکل 19).برای برقراری یک خوانده OD که بازگو کننده مرز بالای منفی بودن (طوری که همه سرم های منفی بررسی شده باشند) باشد یک ارزیابی آماری از توزیع لازم است.بطور کلی از آنجایی که توزیع خمیده است یک مقدار دو برابری از میانگین OD همه سرم های منفی، معلوم شده که مرز بالای منفی بودن ( که منطبق بر مرز پایین مثبت بودن است) را با حد 95% اطمینان تعیین میکند.بنابراین ما 95% مطمین هستیم که اگر یک نمونه مقدار OD آن برابر یا بزرگتر از مقدار دوبرابری میانگین جمعیت سرم منفی باشد.در عمل یک حد اطمینان 99% را میتوان به نتایج برابر یا بزرگتر از دوبرابر میانگین جمعیت نسبت داد.
- 4.5.3.مشکلات
- هنگام بررسی جمعیت سرمی منفی ، ما منفی بودن را با استفاده از یک یا چند فاکتور درنظر میگیریم مانند دیگر نتایج سرولوژیکی ، تاریخچه بالینی حیوانات و فاکتورهای همه گیرشناسی.بنابراین شناسایی حیوان های سرم منفی در کشورهایی که یک بیماری خاص دیده نشده است ،آسان است.با این حال این در مورد کشورهایی که بیماری اندمیک دارند یا کشورهایی که واکسیناسیون را در زمانهای مختلف انجام میدهند صدق نمیکند.درچنین شرایطی آزمایشگر باید بهترین ارزیابی را از حیوان های منفی احتمالی داشته باشد.در این مورد پس از رسم نمودار منحنی های فراوانی یکی از چندین توزیع ممکن است بدست آید.
1). شکل 19: یک پیک در انتهای OD پایین توزیع وجود دارد.این جمعیت احتمالا با همه سرم هایی که OD پایین نشان میدهند منفی است.
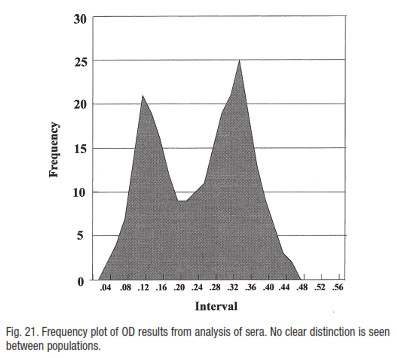
2). شکل 20 : دو قله به طور نسبی در OD پایین و در انتهای OD بالای توزیع خوب از هم جدا شده اند.جمعیت های مشخص از حیوانات که مثبت و منفی هستند ممکن است عفنونت اخیر یا واکسیناسیون را نشان دهند.
3). شکل 21 : دو پیک در هم آمیخته شده اند.مرز مشخصی بین جمعیت ها وجود ندارد ( OD های بالا و پایین خیلی همپوشانی دارند).همچنین این منحنی ها نشان میدهند که تصویر، پس از نمونه برداری از کل جمعیت که شامل حیوانات منفی و مثبت است چگونه خواهد بود.بنابراین برای مثال در شکل 19 مشکلی در نسبت دادن یک مرز بالا در منفی بودن وجود ندارد.این سرم ها آشکارا نوع نتایج قابل انتظار از یک جمعیت کاملا منفی را نشان میدهند.با این حال در شکل 20 ما یک درصدی از نتایج OD بالا را داریم.
این احتمالا نمایانگر حیوانات مثبت است و ما میتوانیم از تمایز روشن بین دو توزیع بدست آمده بهره برده و محکم بگوییم که نتایج با OD پایین نمایانگر جمعیت سرمی منفی است.
توزیع در شکل 21 نشان دهنده وضعیتی است که یک جمعیت ناهمگون از حیوانات در رابطه با سطح آنتی بادی ها وجود دارد.بنابراین ممکن است که گستره OD پایین که در شکل های 19 و 20 نشان داده شده اند نمایانگر حیوانات منفی باشند.آمیخته شدن نتایج بالا و پایین با شمار بالایی از حیوانات ممکن است نشانگر این باشد که سطح آنتی بادی ها در جمعیت پس از یک عفونت گذشته کاهش یافته باشد.چنین جمعیتی را میتوان با استفاده از یک جمعیت منفی تعریف شده ( ممکن است از یک منبع دیگر تهیه شده باشد) بررسی کرد اما توزیع منفی را نمیتوان از یک چنین مطالعه ای با این چنین توزیع به تنهایی ارزیابی کرد.به این ترتیب ،آزمایشگر ممکن است نمونه های سرمی را از گونه های مربوط از کشورهایی فراهم کنند که بیماری در آن کشور وجود نداشته باشد.مقدارهای منفی بدست آمده از چنین سرم هایی ممکن است همیشه همانند منبع های درونزاد نباشد اما برای بیشتر آزمایش ها کافی خواهد بود.
- 4.6.ایجاد سرم های منفی کنترل
- استفاده از شمار کمی سرم منفی بعنوان کنترل در هر سنجش آنتی بادی امکان پذیر است.این کار شدنی است تنها اگر توزیع شمار زیادی از سطح OD سرم منفی را داشته باشیم ( دست کم 100 تا ).بنابراین یک سرم که نمایانگر میانگین جمعیت سرم های منفی است را میتوان بکار برد.اگر این به عنوان یک رقت تک در الایزای غیر مستقیم بکاربرده شود ارزش های OD که برای آن بدست می آید نمایانگر مقدار میانگین برای جمعیت سرم منفی است.مرز بالای منفی بودن را آنگاه میتوان با ضرب این مقدار در 2 بدست آورد البته همانطور که میدانیم این یک مقدار محاسبه ای است که پس از بررسی توزیع بدست می آید.
اگر ارزیابی به وسیله چشم انجام میشود سرم های منفی کنترل که مقدار OD آنها به اندازه مرز بالای منفی بودن (حدود دو برابر میانگین ) است را میتوان استفاده کرد.تشکیل رنگ در چنین سنجشهایی باید تا جایی پیش برود که رنگ همانند کنترلهای منفی قابل تشخیص باشد.آنگاه آزمایش باید متوقف شود.بنابراین هر چاهکی که رنگ آن شدیدتر از چاهکهای کنترل است از نظر آنتی بادی مثبت خواهد بود.
- 4.6.1.آنالیز داده ها
- شما اکنون میانگین OD جمعیت سرمی منفی را بهمراه SD این جمعیت بدست آورده اید.اکنون یک سرمی را پیدا کنید که نمایانگر میانگین جمعیت باشد به همراه یک نمونه ای دیگر که مرز بالا (دو برابر میانگین ) جمعیت را مشخص کند .
4.7.ارتباط رقتهای تکی آزمایش به منحنی های آنتی سرمی مثبت استاندارد
اگر یک آنتی سرم معلوم در دسترس باشد میتوان آن را بعنوان استاندارد در الایزای غیر مستقیم بکار برد.در این مورد یک بازه رقتی کامل از سرم تحت شرایط یکسان با رقت های تکی سرم های آزمایش انجام شده و تیتر میگردد.
یک چارچوب نمونه از پلیت در شکل 22 نشان داده شده است.در پایان آزمایش یک منحنی استاندارد که مقدار OD را به رقتهای سرم مثبت استاندارد وصل میکند ساخته میشود.تیتر نمونه های آزمایش را میتوان از روی این منحنی خواند و ارزیابی نسبی از فعالیت را بدست آورد.این در شکل 23 نشان داده شده است.
به سرم استاندارد میتوان یک فعالیت دلخواه (واحد ) نسبت داد تا اینکه نتایج بر پایه آن واحد گزارش شود.چنین سرم های مثبتی هنگام استاندارد سازی میان آزمایشگاه ها لازم است.
4.8.پیچیدگی های بیماری واقعی
بررسی بسیاری از سیستم ها نشان داده است که نتایج مثبت کاذب در درصد کمی از حیوانات حتی در یک جمعیت کاملا عفونت نیافته دیده شده است.سخت است که تعیین کنیم که چرا چنین واکنشهایی رخ میدهند اما چندین دلیل بیان شده است مانند آلودگی سرم با باکتری ها و قارچها ، فاکتورهای غذایی و گرما دادن سرم ها .درصد این ها 1 تا 2% است ، این ها به آسانی از روی OD بالایشان شناخته میشوند در مقایسه با نمون هایی که توزیع منفی دارند و هم اکنون بحث شدند.این غیر اختصاصیت را میتوان حذف کرد مثلا با بکارگیری فراورده های آنتی ژنی مختلف.با این حال باید شمار نتایج مثبت کاذب را هنگام تشخیص بیماری به حساب آورد.بنابراین اگر بدانیم که 2 حیوان در 100 تا این پاسخ را نشان میدهند و 20 حیوان را در 100 تا بیابیم که پاسخ های بالا نشان دهند احتمال دارد که بیماری تشخیص داده شود.با این حال اگر تنها یکی از سه حیوان مثبت باشند ، این یافته میتواند ناشی از واکنشهای غیر اختصاصی شناخته شده باشد.
5.استفاده از آنتی بادی ها در فاز جامد در کپچر الایزا
این بخش الایزای ساندویچ را در اندازه گیری آنتی ژنها و آنتی بادی ها بررسی میکند.
5.1. استفاده از کپچر الایزا در شناسایی و تیتر آنتی ژن
.1مناسب سازی مقدار آنتی بادی به دام اندازنده که به چاهک ها میچسبد.
.2مناسب سازی آنتی بادی شناسایی کننده
5.1.1.یادگیری اصول
5.1.2.نمای واکنش
که I = چاهکهای میکروپلیت (فاز جامد) ،ABx= آنتی بادی به دام اندازنده (گونه X) اختصاصی به Ag ، Ag= آنتی ژن ، Aby= آنتی بادی شناسایی کننده (گونه y) اختصاصی به Ag ، Anti-Ab*E= آنتی بادی ضد گونه Y متصل به آنزیم ، S= سیستم آشکارسازی رنگ و سوبسترا، W= مرحله شستشو و += اضافه کردن و همدما کردن واکنش گر ها .
در این آزمایش آنتی بادی به دام اندازنده و آنتی بادی شناساگر و کنژوگه در رقتهای مناسبشان استفاده میشوند.
5.1.3.پایه های سنجش
وضعیتهای زیر ممکن است درباره آنتی ژنها رخ دهد.
- بسیار ضعیف به پلاستیک بچسبد
- به مقدار کم وجود داشته باشد مثلا در مایع های کشت بافتی
- با درصد کمی از کل پروتیین در یک نمونه ناخالص (مثلا در مدفوع یا نمونه های بافتهای پوششی ) وجود داشته باشد
-
برای تخلیص و تغلیظ در دسترس نباشد چون از نظر آنتی ژنتیکی در هنگام جداسازی از دیگر اجزا ،ناپایدار هستند. در این موارد سنجش غیر مستقیم برای برخورد با آنتی ژن مناسب نیست چون این روش تکیه بر چسبیدن مستقیم آنتی ژن به چاهک ها دارد.سنجش از نوع کپچر بر بسیاری از این مشکلات غلبه میکند جرا که آنتی ژن با واسطه آنتی بادی های اختصاصی به چاهک ها می چسبد.سنجش وابسته به دسترس بودن دو آنتی سرم از گونه های مختلف دارد طوری که کنژوگه با آنتی بادی دوم ( آنتی بادی شناساگر) واکنش میدهد اما با آنتی بادی کپچر (به دام اندازنده) واکنش نمیدهد.همچنین این ضروری است که آنتی ژن دست کم دو جایگاه آنتی ژنی داشته باشد تا آنتی بادی که به آن وصل میشود بتواند ساندویچ تشکیل دهد.بنابراین هنگامی که آنتی ژنهای کوچک (مانند پپتیدها) استفاده میشوند ممکن است در چنین سنجشهایی بخاطر جایگاههای آنتی ژنی محدودشان واکنش ندهند.این نوع سنجش یک برتری بر سنجش غیر مستقیم در تعیین مقدار آنتی ژنها دارد چرا که چسبیدن مستقیم پروتیین ها به چاهک ها بیشتر غیر خطی است به عبارت دیگر متناسب با مقدار پروتیین در نمونه نیست .این وضع بدتر خواهد شد اگر پروتیین های آلوده کننده (اجزای سرمی ) به همراه آنتی ژن وجود داشته باشند چون این پروتیین ها میتوانند با کینتیکی غیرخطی بر سر جایگاههای پلاستیک رقابت کنند. از آنجایی که آنتی بادی به دام اندازنده اختصاصی است به طور متناسب در یک بازه گسترده ای از غلظتهای پروتیین به آنتی ژن متصل میشوند.بنابراین چنین سنجشهایی هنگامی که تعیین مقدار نیاز است نتایج تکرار پذییری را بدست میدهند. این سنجش از نظر شیوه یکسان با سنجش غیر مستقیم است به جز اینکه یک گام اضافی ( آنتی بادی به دام اندازنده ) افزوده شده است.ما سه پارامتر را باید مناسب سازی کنیم.
.1آنتی بادی کپچر (آنتی بادی گیرنده)
.2آنتی بادی شناساگر
.3کنژوگه ضد آنتی بادی شناساگر 5.1.4.مواد
- آنتی بادی گیرنده (ABx) : ایمنوگلوبولین گوسفندی ضد خوکچه هندی (sheep anti-guinea pig Ig) ( یک فراورده IgG با غلظت 5 mg/mL در PBS).
- Ag : Guinea pig Ig با غلظت 1mg/mL یا بصورت فراورده ای که توسط کاربر فراهم شده است.
- آنتی بادی شناساگر (AbY) : rabbit anti-guinea pig Ig serum (Ab)
- Anti-Ab*E : sheep anti-rabbit conjugate (HRP) .
- میکروپلیت ها
- پی پتهای چند کاناله ، تک کاناله ، 10 mL ، و 1 mL .
- بافر کربنات / بی کربنات با pH 9.6 .
- PBS 1%BSA / Tween-20 (0.05%) .
- محلول OPD در سیترات بافر
- پراکسید هیدروژن 30% (w/v) .
- محلول شستشو
- سولفوریک اسید 1 M در آب.
- حوله های کاغذی
- بطری هایی با حجم کوچک
- اسپکتروفتومتر چند کاناله
- ساعت
-
کاغذ رسم نمودار 5.1.5.روش ها
از آنجایی که اکنون شما با سنجش غیر مستقیم آشنا هستید گام های مناسب سازی کپچر الایزا باید آسان باشد.اولین گام پایه ای تعیین مقدار آنتی بادی گیرنده ای است که به چاهک ها می چسبد.ما دو حالت در آزمایشگاه داریم بسته به دسترس بودن ریاجنتها .ممکن است ما یک آنتی بادی گیرنده بصورت یک فراورده IgG داشته باشیم یا اگر یک سرم به اندازه کافی با تیتر بالا ضد آنتی ژن در دسترس باشد .آسان ترین راه برای دور ماندن از اثرات سرم فراهم کردن IgG است.جداسازی با نمک معمولا کافی بوده و بر فعالیت آنتی بادی اثر نمیگذارد.مراقب اثرات فراورده های شیمیایی IgG از آنتی بادی های منوکلونال باید بود.
استفاده از فراورده های ایمنوگلوبولین
برتری استفاده از فراورده های IG آن است که وزن ایمنوگلوبولین را میتوان حساب کرد و مقدار معینی از ریاجنت را به پلیت افزود.بطور کلی یک مقدار بیشینه ای از پروتیین به چاهک ها خواهد چسبید.چون میدانیم که اتصال بیشینه مقدار آنتی ژن افزوده شده مورد انتظار است بنابراین ما ایمونوگوبولین را در سطح اشباع آن می افزاییم.بنابراین یک براورد خوب از فعالیت آنتی بادی گیرنده ( رقت یا غلظت خاصی که باید استفاده شود) را میتوان ارزیابی کرد.به عنوان مثال اگر آنتی بادی گیرنده به میزان 5 ug/mL در 50uL افزوده شود نمایانگر مقدار اشباع کنندگی از آنتی بادی است که به چاهک ها خواهد چسبید.فعالیت نهایی بستگی به غلظت ایمنوگلوبولین اختصاصی (ضد آنتی ژن) در آنتی بادی گیرنده و فاصله مولکولهای گیرنده از هم دارد.
برخی سنجشها در سطحهای پایین تر از سطح اشباع آنتی بادی گیرنده عمل میکنند بنابراین تیتراسیون لازم است .بطور کلی مقدار آنتی بادی اختصاصی در یک سرم بصورت درصد از کل پروتیین در حد 1-5 % است.فراورده ایمونوگلوبولین درصد بزرگی از پروتیین های سرم را نمیگذارد که در سنجش دخیل شوند (مثلا آلبومین سرم).بنابراین فعالیت پروتیین ایمونوگلوبولین ( افزایش نسبی بخش IgG که به هر چاهک خواهد چسبید) بطور موثری افزایش خواهد یافت .به عبارت دیگر بخش بزرگتری از IgG وجود خواهد داشت که به چاهک ها خواهد چسبید و بعنوان آنتی بادی گیرنده عمل خواهند کرد.
استفاده از سرم کامل
رقتهایی از سرم دست نخورده را میتوان بکار برد.با این حال همانطور که در بالا گفته شد نسبت IgG اختصاصی پایین است و دیگر پروتیین های سرم به شیوه ای رقابتی خواهند چسبید.پوشاندن چاهکها با یک رقت پایین از سرم کامل سطح خوبی از آنتی بادی گیرنده را به دست خواهد داد.پدیده ای بیشتر معمول آن است که یک منحنی زنگوله مانند از فعالیت گیرندگی را با فعالیت کم در غلظتهای بالای سرمی و افزایش فعالیت ،همینکه سرم رقیق میشود را داریم.بطور کلی سرم باید تا رقت 1/500 – 1/2000 رقیق شود.بنابراین ما باید سرم هایی به تیتر نسبی بسیار بالا داشته باشیم تا بتوانیم از سرم کامل استفاده کنیم.